
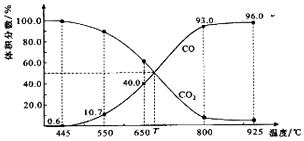
| A. | 550℃时,若充入惰性气体,v正、v逆均减小,平衡不移动 | |
| B. | 650℃时,反应达平衡后CO2的转化率为25.0% | |
| C. | T℃时,若充入等体积的CO2和CO,平衡向逆反应方向移动 | |
| D. | 925℃时,用平衡分压代替平衡浓度表示的化学平衡常数Kp=24.0P总 |
分析 A.可变的恒压密闭容器中反应,550℃时若充入惰性气体,相当于减小压强,则v正,v退均减小,又改反应是气体体积增大的反应,则平衡正向移动;
B.由图可知,650℃时,反应达平衡后CO的体积分数为40%,设开始加入的二氧化碳为1mol,根据三段式进行计算;
C.由图可知,T℃时,反应达平衡后CO和CO2的体积分数都为50%即为平衡状态;
D.925℃时,用平衡分压代替平衡浓度表示的化学平衡常数Kp=$\frac{p{\;}^{2}(CO)}{P(CO{\;}_{2})}$,据此计算.
解答 解:A.可变的恒压密闭容器中反应,550℃时若充入惰性气体,相当于减小压强,平衡向着正向移动,v正,v退均减小,故A错误;
B、由图可知,650℃时,反应达平衡后CO的体积分数为40%,设开始加入的二氧化碳为1mol,转化了xmol,
则有C(s)+CO2(g)?2CO(g)
开始 1 0
转化 x 2x
平衡; 1-x 2x
所以$\frac{2x}{1-x+2x}$×100%=40%,解得x=0.25mol,则CO2的转化率为:$\frac{0.25}{1}$×100%=25.0%,故B正确;
C.由图可知,T℃时,反应达平衡后CO和CO2的体积分数都为50%即为平衡状态,所以平衡不移动,故C错误;
D.925℃时,CO的体积分数为96%,则CO2的体积分数都为4%,所以用平衡分压代替平衡浓度表示的化学平衡常数Kp=$\frac{p{\;}^{2}(CO)}{P(CO{\;}_{2})}$=$\frac{(0.96p){\;}^{2}}{0.04p}$=23.04P,故D错误;
故选B.
点评 本题考查了化学平衡的计算,题目难度中等,明确图象曲线变化的含义为解答关键,注意掌握化学平衡及其影响因素,试题培养了学生的分析能力及灵活应用能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 有人称“一带一路”是“现代丝绸之路”,丝绸的主要成分是纤维素,属于天然高分子化合物 | |
| B. | 陶瓷、水泥和玻璃都属于硅酸盐产品 | |
| C. | 废旧钢材焊接前,可依次用饱和Na2CO3溶液、饱和NH4Cl溶液处理焊点 | |
| D. | 使用可降解的聚碳酸酯塑料和向燃煤中加入生石灰,都能减轻环境污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
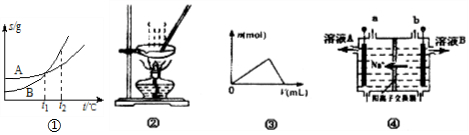
| A. | 图①表示A、B两物质的溶解度随温度变化情况,将t1℃时A、B饱和溶液分别升温至t2℃时,溶质的质量分数B>A | |
| B. | 用图②所示装置蒸发FeCl3溶液制备无水FeCl3 | |
| C. | 图③可以表示向一定量的明矾溶液中逐滴摘加一定浓度氢氧化钡溶液时产生Al(OH)3沉淀的物质的量变化 | |
| D. | 图④电解饱和食盐水的装置中,溶液A、B中由水电离出的c(H+):A>B |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验 | 现象 | 结论 |
| A | 植物油和溴水混合后振荡、静置 | 溶液分层,溴水褪色 | 植物油萃取了溴水中的Br2 |
| B | 将Cl2通入滴有酚酞NaOH的溶液 | 褪色 | Cl2具有漂白性 |
| C | 将过量的CO2通入CaCl2溶液 | 无白色沉淀生成 | 生成的Ca(HCO3)2可溶于水 |
| D | 将浓硫酸滴到胆矾晶体上 | 晶体逐渐变白色 | 浓硫酸的吸水性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(N2)=2.25 mol/L | B. | c(NH3)=1.9 mol/L | C. | c(H2)=0.3 mol/L | D. | c(N2)=1.3mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 干电池中Zn为正极,碳为负极 | |
| B. | 干电池可以实现化学能向电能的转化和电能向化学能的转化 | |
| C. | 干电池长时间连续使用时内装糊状物可能流出腐蚀电器 | |
| D. | 干电池工作时,电子由碳极经外电路流向Zn极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下1molCl2和足量氢氧化钠溶液充分反应,转移电子数目为2NA | |
| B. | 12 g石墨烯(单层石墨)中含有六元环的个数为0.5NA | |
| C. | 0.1molFe与稀硝酸恰好反应完后,溶液中NO3-的数目为0.3NA | |
| D. | l L pH=l的硫酸溶液中含有的H+数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol HNO3见光分解,转移的电子数为4NA | |
| B. | 25℃时,1LpH=1的H2SO4溶液中含有的H+数为0.1NA | |
| C. | 28 g乙烯与丙烯的混合物中含有的共用电子对数为6NA | |
| D. | 将0.5molNH4NO3溶于稀氨水中使溶液呈中性,溶液中NH4+的数目为0.5NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com