

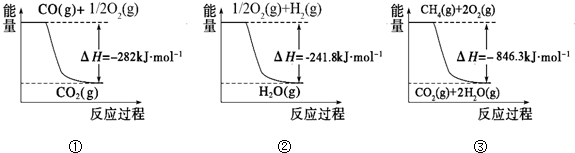
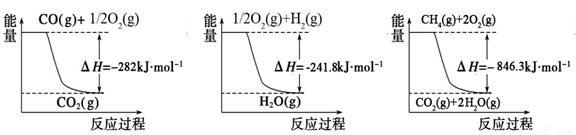
 O2��g���TCO2��g����H=-282kJ?mol-1 ��H2��g��+
O2��g���TCO2��g����H=-282kJ?mol-1 ��H2��g��+ O2��g���TH2O��g����H=-241.8kJ?mol-1
O2��g���TH2O��g����H=-241.8kJ?mol-1

 ����ѵ�����⿼ϵ�д�
����ѵ�����⿼ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| c(H2O) |
| c(CO2)c2(NH3) |
| c(H2O) |
| c(CO2)c2(NH3) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014ѧ���㽭ʡ������ʮУ�����������ѧ����ĩ�������ۻ�ѧ�Ծ��������棩 ���ͣ������
��������Ҫ�Ļ�����Ʒ֮һ��
��1���ϳɰ��õ��������Լ���Ϊԭ���Ƶ�:CH4(g)+H2O(g�� CO(g)+3H2(g)���йػ�ѧ��Ӧ�������仯����ͼ��ʾ��CH4(g)��H2O(g)��Ӧ����CO(g)��H2(g)���Ȼ�ѧ����ʽΪ
��
CO(g)+3H2(g)���йػ�ѧ��Ӧ�������仯����ͼ��ʾ��CH4(g)��H2O(g)��Ӧ����CO(g)��H2(g)���Ȼ�ѧ����ʽΪ
��



��2��CO�Ժϳɰ��Ĵ����ж������ã��������������ͭ(��)��Һ������ԭ������CO���䷴Ӧԭ��Ϊ��[Cu(NH3)2CH3COO](l)+CO(g)+NH3(g) [Cu(NH3)3]CH3COO��CO(l�� ��H��0������CO�������ͭ��Һ�����ʵ��������ֿ��������ָ�������CO�������Թ�ѭ��ʹ�ã����������������� __________����дѡ���ţ���
[Cu(NH3)3]CH3COO��CO(l�� ��H��0������CO�������ͭ��Һ�����ʵ��������ֿ��������ָ�������CO�������Թ�ѭ��ʹ�ã����������������� __________����дѡ���ţ���
A�����¡���ѹ B�����¡���ѹ C�����¡���ѹ D�����¡���ѹ
��3���ð�����ȡ����[CO(NH2)2]�ķ�ӦΪ��2NH3(g)+CO2(g) CO(NH2)2(l)+H2O(g�� ��H��0��ij�¶��£����ݻ�Ϊ100L���ܱ�������ͨ��4mol
NH3��2molCO2���÷�Ӧ���е�40 sʱ�ﵽƽ�⣬��ʱCO2��ת����Ϊ50%�����¶��´˷�Ӧƽ�ⳣ��K��ֵΪ________����ͼ�е����߱�ʾ�÷�Ӧ��ǰ25 s�ڵķ�Ӧ�����е�NH3Ũ�ȱ仯������Ӧ������70s����������������������£�����ͼ����ʵ����ʹ�ô���ʱ�÷�Ӧ�Ľ������ߡ�
CO(NH2)2(l)+H2O(g�� ��H��0��ij�¶��£����ݻ�Ϊ100L���ܱ�������ͨ��4mol
NH3��2molCO2���÷�Ӧ���е�40 sʱ�ﵽƽ�⣬��ʱCO2��ת����Ϊ50%�����¶��´˷�Ӧƽ�ⳣ��K��ֵΪ________����ͼ�е����߱�ʾ�÷�Ӧ��ǰ25 s�ڵķ�Ӧ�����е�NH3Ũ�ȱ仯������Ӧ������70s����������������������£�����ͼ����ʵ����ʹ�ô���ʱ�÷�Ӧ�Ľ������ߡ�

��4��������ʩ����������ͨ��ת��Ϊ̼��炙�̼����狀�ű����������ã����ط�����������ڵ���ø�����£�ת��Ϊ̼��李���֪���������ˮ�еĵ���ƽ�ⳣ����25�棩���±���
|
������� |
H2CO3 |
NH3��H2O |
|
����ƽ�ⳣ�� |
Ka1=4.30��10-7 Ka2=5.61��10-11 |
1.77��10-5 |
���г�����0.1 mol��L-1��(NH4)2CO3��Һ��
������Ϊ����Һ�� �ԣ���ᡱ�����С����������ԭ���� ��
�ھ���Һ������֮�������й�ϵʽ������Ϊ������ȷ���� ��
A��c(NH4+)��c(CO32-)��c(HCO3-)��c(NH3��H2O)
B��c(NH4+)+c(H+)��c(HCO3-)+c(OH-)+c(CO32-)
C��c(CO32-��+ c(HCO3-��+c(H2CO3)��0.1 mol��L-1
D��c(NH4+)+ c(NH3��H2O)��2c(CO32-��+ 2c(HCO3-��+2c(H2CO3)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012-2013ѧ��㶫ʡ�����и������в������ۻ�ѧ�Ծ��������棩 ���ͣ�������
��������Ҫ�Ļ�����Ʒ֮һ��
��1���ϳɰ��õ��������Լ���Ϊԭ���Ƶá��йػ�ѧ��Ӧ�������仯����ͼ��ʾ��
��Ӧ�٢ڢ�Ϊ_________��Ӧ������ȡ����ȡ�����CH4(g)��H2O(g)��Ӧ����CO(g)��H2(g)���Ȼ�ѧ����ʽΪ__________________��
�� �� ��
��2���ð�����ȡ����[CO(NH2)2]�ķ�ӦΪ��2NH3(g)+CO2(g)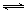 CO(NH2)2(l)+H2O(g)��
CO(NH2)2(l)+H2O(g)��
��ij�¶��£����ݻ�Ϊ10L���ܱ�������ͨ��2mol NH3��1molCO2����Ӧ�ﵽƽ��ʱCO2��ת����Ϊ50%���÷�Ӧ�Ļ�ѧƽ�ⳣ������ʽΪK=___________�����¶���ƽ�ⳣ��K�ļ�����Ϊ____________��
��Ϊ��һ�����CO2��ƽ��ת���ʣ����д�ʩ���ܴﵽĿ�ĵ���_____________
A�����NH3��Ũ�� B������ѹǿ
C����ʱת�����ɵ����� D��ʹ�ø���Ч�Ĵ���
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com