
| A.将体积减小至原来的一半 |
| B.加入催化剂 |
| C.将反应温度升高至1000℃ |
| D.增大水蒸气的浓度 |
科目:高中化学 来源:不详 题型:单选题
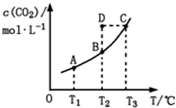
| A.反应CO(g)+H2O(g)?CO2(g)+H2(g)的△H>0 |
| B.在T2时,若反应处于状态D,则一定有ν正<ν逆 |
| C.平衡状态A与C相比,平衡状态A的c(CO)小 |
| D.若T1、T2时的平衡常数分别为K1、K2,则K1<K2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
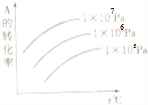
| A.m+n<p+q;Q>0 | B.m+n>p+q;Q>0 |
| C.m+n<p+q;Q<0 | D.m+n>p+q;Q<0 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.2mol SO2+1mol O2 |
| B.4mol SO2+1mol O2 |
| C.2mol SO2+1mol O2+2mol SO3 |
| D.3mol SO2+1mol SO3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 高温 |
| 温度 | 25℃~550℃~600℃~700℃ |
| 主要成份 | WO3W2O5WO2W |
| 1400℃ |
| 约3000℃ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题

| 温度/℃ | 400 | 500 | 830 |
| 平衡常数K | 10 | 9 | 1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
| 1 |
| 2 |


查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com