
下表是元素周期表的一部分,有关说法正确的是( )
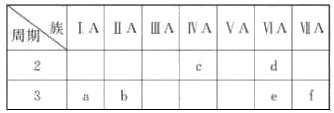
A.e的氢化物比d的氢化物稳定
B.a、b、e三种元素的原子半径:e>b>a
C.6种元素中,c元素单质的化学性质最活泼
D. c、e、f的最高价氧化物对应的水化物的酸性依次增强
科目:高中化学 来源:2014高考化学名师知识点精编 专题10盐类水解与沉淀溶解平衡练习卷(解析版) 题型:选择题
下列应用与盐类的水解无关的是( )
A.纯碱溶液可去除油污
B.NaCl可用作防腐剂和调味剂
C.TiCl4溶于大量水加热制备TiO2
D.FeCl3饱和溶液滴入沸水中制Fe(OH)3胶体
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题8电解质溶液练习卷A(解析版) 题型:选择题
下列叙述正确的是( )
A.0.1 mol/L CH3COONa溶液中:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
B.NH4Cl溶液加水稀释后,恢复至原温度,pH和KW均增大
C.pH=4的CH3COOH溶液和pH=4的NH4Cl溶液中,c(H+)不相等
D.在NaHCO3溶液中:c(OH-)+c(CO32—)=c(H+)+c(H2CO3)
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题7化学反应速率和化学平衡练习卷A(解析版) 题型:选择题
纳米钴(Co)常用于CO加氢反应的催化剂,500 K时有催化反应:CO(g)+3H2(g) CH4(g)+H2O(g) ΔH<0。下列有关说法正确的是( )
CH4(g)+H2O(g) ΔH<0。下列有关说法正确的是( )
A.纳米技术的应用,提高了催化剂的催化性能
B.缩小容器体积,平衡向正反应方向移动,CO的浓度减小
C.温度越低,越有利于CO催化加氢
D.从平衡体系中分离出H2O(g)能加快正反应速率
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题7化学反应速率和化学平衡练习卷A(解析版) 题型:选择题
在常温下,X2(g)和H2反应生成HX的平衡常数如表中所示,仅依据K的变化,关于等物质的量浓度的H2与X2的反应,下列说法正确的是( )
化学方程式 | 平衡常数K |
F2+H2 | 6.5×1095 |
Cl2+H2 | 2.6×1033 |
Br2+H2 | 1.9×1019 |
I2+H2 | 8.7×102 |
A.F2的转化率最大
B.X2与H2反应的剧烈程度逐渐减弱
C.X2与H2反应的反应速率依次减小
D.升高温度,平衡常数都增大
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题6物质结构与元素周期律练习卷(解析版) 题型:选择题
已知X、Y、Z、W四种短周期元素在周期表中的相对位置如图所示,下列说法正确的是( )

A.Z元素的原子半径可能比Y元素的小
B.W的原子序数可能是Y的原子序数的2倍
C.W的气态氢化物的稳定性一定比Y的强
D.Z的化学活泼性一定比X强
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题5化学反应中的能量变化练习卷(解析版) 题型:填空题
化学反应可视为旧键断裂和新键形成的过程。现提供H2燃烧反应中有关物质的化学键键能: H—H键键能为Q1 kJ·mol-1、H—O键键能为Q3 kJ·mol-1、O2分子内氧原子间的键能为Q2 kJ·mol-1。
(1)请根据上述数据,在图中标注的数字处,填出能量变化的数值或根据箭头的指向填写能量变化是“放出”热量还是“吸收”热量。
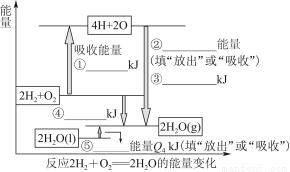
(2)请写出1 molH2燃烧生成液态水的热化学反应方程式:____________________________。
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题4离子反应练习卷(解析版) 题型:选择题
下列有关离子反应或离子方程式的叙述中,正确的是( )
A.能使pH试纸显深红色的溶液中,Fe3+、Cl-、Ba2+、Br-能大量共存
B.惰性电极电解氯化铝溶液:2Cl-+2H2O Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
C.镁与极稀硝酸反应生成硝酸铵的离子方程式为4Mg+6H++NO3—=4Mg2++NH4++3H2O
D.将10 mL 0.1 mol·L-1 KAl(SO4)2溶液和10 mL 0.2 mol·L-1Ba(OH)2溶液混合,得到的沉淀中Al(OH)3和BaSO4的物质的量之比为1∶2
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题14综合实验与探究练习卷A(解析版) 题型:实验题
一定浓度NaHCO3溶液与CuSO4溶液反应后生成了蓝绿色颗粒状沉淀。就沉淀成分提出了如下三种假设:
假设一:沉淀是CuCO3;假设二:沉淀是Cu(OH)2;
假设三:沉淀是CuCO3和Cu(OH)2的混合物。
(1)写出假设二,沉淀是Cu(OH)2生成的理由 (用离子方程式表示);
(2)为了探究沉淀的成分,取出了一部分沉淀,滴加稀盐酸,有气体放出。凭此现象,判断沉淀中含有 _;
(3)为了进一步探究沉淀的成分,进而确定假设中何种假设成立,设计实验,装置图如下:

①研究沉淀物组成前,须将沉淀从溶液中分离并净化。具体操作依次为 _ 、洗涤、干燥;
②装置E中药品的名称是 __作用为 __;
③实验过程中有以下操作步骤:a.打开K1、K3,关闭K2、K4,通入过量空气。此步骤的作用是 ;
b.关闭K1、K3,打开K2、K4,充分反应,c.再通入过量空气时,活塞处于打开的是 _,关闭的是 _。
④若沉淀样品的质量为m g,装置D的质量增加了n g;若沉淀样品为纯净物,m、 n之间的关系为 _
若假设三成立,则Cu(OH)2的质量分数为 _;若不进行步骤c,则会使测得结果 (填“偏高”“无影响”“偏低”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com