
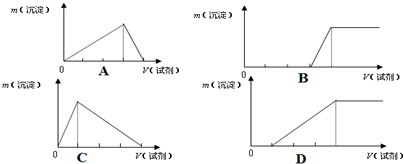


科目:高中化学 来源: 题型:
| 平行实验编号 | Na2C2O4质量 (m g) | 滴定管起始读数(mL) | 滴定管滴定终点读数(mL) |
| 1 | 1.34 | 0.00 | 25.02 |
| 2 | 1.34 | 0.02 | 25.00 |
| 3 | 1.34 | 0.18 | 25.18 |
查看答案和解析>>
科目:高中化学 来源: 题型:
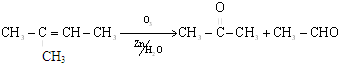 从石油分馏产品C8H18制取二氢茉莉酮酸甲酯(香料)的流程如图:(备注:E是D的一元取代物)
从石油分馏产品C8H18制取二氢茉莉酮酸甲酯(香料)的流程如图:(备注:E是D的一元取代物)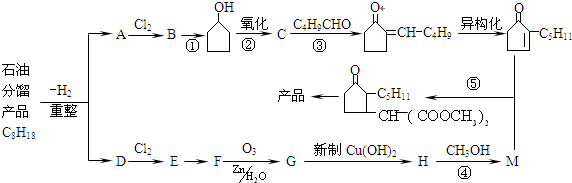
查看答案和解析>>
科目:高中化学 来源: 题型:
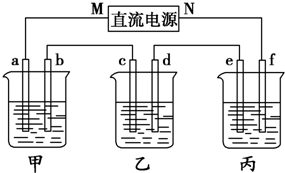 如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极.
如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、V碱=102V酸 |
| B、V酸=102 V碱 |
| C、V酸=2V碱 |
| D、V碱=2V酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、PbO2是电池的负极 |
| B、负极的电极反应式为:Pb+SO42--2e -=PbSO4↓ |
| C、PbO2得电子,被氧化 |
| D、电池放电时,溶液酸性增强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com