
| A. | 鉴别乙烷与乙烯或除去乙烷中的少量乙烯杂质都可用高锰酸钾酸性溶液 | |
| B. | 某同学需用480 mL 2.0 moI•L-1氢氧化钠溶液进行实验,则配制该溶液时他称取氢氧化钠固体质量一定是38.4 g | |
| C. | 向含Fe3+的溶液中加入KSCN溶液时一定有红褐色沉淀产生 | |
| D. | 硝酸钾和稀硫酸的混合溶液中加入铜粉后,溶液会慢慢变蓝 |
分析 A.乙烯能被酸性高锰酸钾溶液氧化生成二氧化碳;
B.实验室没有480mL容量瓶,应该用500mL容量瓶配制一定物质的量浓度溶液,称量氢氧化钠质量=2.0mol/L×0.5L×40g/mol;
C.铁离子和KSCN溶液发生络合反应生成络合物;
D.酸性条件下,硝酸根离子具有强氧化性,能氧化铜等较不活泼金属单质.
解答 解:A.乙烯能被酸性高锰酸钾溶液氧化生成二氧化碳,溴和乙烯反应生成1,2-二溴乙烷,所以应该用溴水除去乙烷中的乙烯,故A错误;
B.实验室没有480mL容量瓶,应该用500mL容量瓶配制一定物质的量浓度溶液,称量氢氧化钠质量=2.0mol/L×0.5L×40g/mol=40g,故B错误;
C.铁离子和KSCN溶液发生络合反应生成络合物而不是沉淀,故C错误;
D.酸性条件下,硝酸根离子具有强氧化性,能氧化铜等较不活泼金属单质,所以该溶液中相当于含有硝酸,能氧化Cu单质生成铜离子,故D正确;
故选D.
点评 本题考查化学实验方案平均,为高频考点,涉及物质分离和提纯、溶液配制、络合物、硝酸的性质等知识点,明确实验原理、物质性质是解本题关键,易错选项是BD,注意容量瓶的选取方法,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 选用480 mL容量瓶,称取12.0g硫酸铜,配成480mL溶液 | |
| B. | 选用250 mL容量瓶,称取12.5g胆矾,配成500mL溶液 | |
| C. | 选用500 mL容量瓶,称取12.5g胆矾,加入500mL水 | |
| D. | 选用500 mL容量瓶,称取12.5g胆矾,配成500mL溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用电子式表示HCl的形成过程: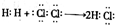 | |
| B. | Mg2+的结构示意图: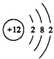 | |
| C. | HClO的结构式:H-Cl-O | |
| D. | 质量数为133,中子数为78的铯原子:${\;}_{55}^{133}$Cs |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .P元素属于p区元素,
.P元素属于p区元素,
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2是淡黄色固体,Na2O 是白色固体,二者都能与水反应生成 NaOH | |
| B. | Na和O2在加热时反应生成 Na2O2,在常温下反应生成 Na2O | |
| C. | Na2O与CO2发生化合反应生成Na2CO3,Na2O2与CO2发生置换反应生成 O2 | |
| D. | 2 g H2充分燃烧后产物被Na2O2完全吸收,Na2O2固体增重2g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 (用元素符号表示)
(用元素符号表示)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com