
【题目】Ⅰ、用0.1 molL-1 NaOH溶液分别滴定体积均为20.00 mL、浓度均为0.1 molL-1的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH溶液体积而变化的两条滴定曲线。

①滴定盐酸的曲线是______________(填“I”或“Ⅱ”);
②滴定开始前,三种溶液中由水电离出的c(H+)最大的是_____________________;
③V1和V2的关系:V1 _____ V2(填“>”、“=”或“<”)。
Ⅱ、已知25℃时,2.0×103 mol/L氢氟酸水溶液中,调节溶液pH(忽略体积变化),得到c(HF)、c(F)与溶液pH的变化关系如图所示。

(1)25℃时,HF的电离平衡常数Ka=_____________。
(2)已知HF(aq)![]() H+(aq)+F(aq) ΔH=10.4 kJ/mol,现将室温下0.1 mol/L HF溶液升温至30℃(不考虑溶质和溶剂的挥发),下列各量增大的是__________。
H+(aq)+F(aq) ΔH=10.4 kJ/mol,现将室温下0.1 mol/L HF溶液升温至30℃(不考虑溶质和溶剂的挥发),下列各量增大的是__________。
a.Ka b.Kw c.n(H+) d. 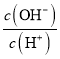
(3)25℃时,在20 mL 0.1 mol/L氢氟酸中加入V mL 0.1 mol/L NaOH溶液,测得混合溶液的pH变化曲线如图所示,下列说法正确的是__________________。

a.pH=3的HF溶液和pH=11的NaF溶液中,由水电离出的c(H+)相等
b.①点时pH=6,此时溶液中,c(F)c(Na+)=9.9×107 mol/L
c.②点时,溶液中的c(F)=c(Na+)
d.③点时V=20 mL,此时溶液中c(F)<c(Na+)=0.1 mol/L
【答案】 Ⅱ 0.1 mol·L-1醋酸溶液 < 10-3.45 bd bc
【解析】I.① 0.1 molL-1的盐酸的pH=1,观察滴定曲线的起点可以确定滴定盐酸的曲线是Ⅱ;
② 滴定开始前,三种溶液中由水电离出的c(H+)最大的是醋酸,因为醋酸是弱酸,其电离出的氢离子浓度远小于同浓度的氢氧化钠和盐酸,所以醋酸对水的电离的抑制作用较小,其中由水电离出的c(H+)最大;
③ 因醋酸钠水解使溶液呈碱性,所以当滴定到pH=7时,醋酸消耗的氢氧化钠较少,所以V1和V2的关系为V1< V2 。
Ⅱ.(1)由图像可知,pH=3.45时,c(F-)=c(HF),c(H+)=10-3.45mol/L,因此25℃时,HF的电离平衡常数Ka=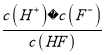 =10-3.45。
=10-3.45。
(2)由HF(aq)![]() H+(aq)+F(aq) ΔH=10.4 kJ/mol可知,HF的电离是放热过程,而水的电离是吸热过程,所以现室温下0.1 mol/L HF溶液升温至30℃(不考虑溶质和溶剂的挥发),HF的电离程度变小,水的电离程度变大。但由于HF的电离常数远大于水,所以溶液中的n(H+)主要由HF决定 ,因此Ka 、n(H+)变小,各量增大的是Kw 和
H+(aq)+F(aq) ΔH=10.4 kJ/mol可知,HF的电离是放热过程,而水的电离是吸热过程,所以现室温下0.1 mol/L HF溶液升温至30℃(不考虑溶质和溶剂的挥发),HF的电离程度变小,水的电离程度变大。但由于HF的电离常数远大于水,所以溶液中的n(H+)主要由HF决定 ,因此Ka 、n(H+)变小,各量增大的是Kw 和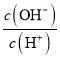 ,选b d。
,选b d。
(3)由图可知,加入20mL 0.1 mol/L NaOH溶液时,到达滴定终点。a. pH=3的HF溶液中,水的电离受到抑制,而pH=11的NaF溶液中,水的电离因氟离子水解而得到促进,所以a不正确; b.①点时pH=6,此时溶液中,c(H+)=10-6mol/L, c(OH-)=10-8mol/L,根据电荷守恒c(Na+)+ c(H+)= c(F)+ c(OH-),可得c(F)c(Na+)=9.9×107 mol/L,b正确;c.由电荷守恒,②点时pH=7,c(H+)=c(OH-),所以溶液中的c(F)=c(Na+),c正确;d.③点时V=20 mL,溶液为氟化钠溶液,因氟离子水解使溶液呈碱性,此时溶液中c(F)<c(Na+)=0.05 mol/L,d不正确。说法正确的是bc。


科目:高中化学 来源: 题型:
【题目】在KCl、FeCl3、Fe2(SO4)3三种盐配成的混合溶液中,若K+为0.15 mol,Fe3+为0.25 mol,Cl-为0.2 mol,则SO42-为
A. 0.1 mol B. 0.15 mol C. 0.25 mol D. 0.35 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 碘化钾溶液遇淀粉变蓝
B. 油脂在酸性条件下的水解反应,也称皂化反应
C. 苯在溴化铁的催化下能与溴水反应
D. 加热时葡萄糖能与新制氢氧化铜反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对滴有酚酞试液的下列溶液,操作后颜色变深的是( )
A. 明矾溶液加热 B. CH3COONa溶液加热
C. 氨水中加入少量NH4Cl固体 D. 小苏打溶液中加入少量NaCl固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合溶液中所含离子的物质的量浓度如表,则M可能为
所含离子 | NO3- | SO42- | H+ | M |
物质的量浓度(molL-1) | 2 | 1 | 3 | 1 |
A.Ba2+B.Mg2+C.F-D.Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个小烧杯里,加入20g Ba(OH)28H2O粉末,将小烧杯放在事先已滴有3~4滴水的玻璃片上,然后向烧杯内加入约10g NH4C晶体,并用玻璃棒迅速搅拌.
(1)实验中玻璃棒的作用是
(2)写出该反应的化学方程式
(3)通过现象,说明该反应为反应.(填“吸热”或“放热”)这是由于反应物的总能量(填“小于”“大于”或“等于”)生成物的总能量.
(4)某同学将实验做了如图之改进,使用浸有稀硫酸的棉花的目的是 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有25 ℃时0.1 mol/L的氨水。请回答以下问题:
(1)若向氨水中加入少量硫酸铵固体,此时溶液中![]() _______(填“增大”“减小”或“不变”)。
_______(填“增大”“减小”或“不变”)。
(2)若向氨水中加入稀硫酸,使其恰好中和,写出反应的离子方程式_____________;若所得溶液的pH=5,则溶液中由水所电离出的氢离子浓度为___________。
(3)若向氨水中加入稀硫酸至溶液的pH=7,此时c(NH4+)=a mol/L,则c(SO42-)=______。
(4)若向氨水中加入pH=1的硫酸,且氨水与硫酸的体积比为1∶1,则所得溶液中各离子物质的量浓度由大到小的关系是_____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.中和热一定是强酸跟强碱反应放出的热量
B.1mol酸与1mol 碱完全反应放出的热量是中和热
C.在稀溶液中,酸与碱发生中和反应生成1mol H2O(l)时的反应热叫做中和热
D.稀硫酸和稀Ba(OH)2溶液反应生成1mol H2O(l)的反应热叫做中和热
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com