
为了测定某浓硫酸样品的物质的量浓度,进行了以下实验操作:
A.冷却至室温后,在100mL容量瓶中定容配成100mL稀硫酸。
B.用某仪器量取20.00mL稀硫酸于锥形瓶中并滴入几滴指示剂。
C.将酸式滴定管和碱式滴定管用蒸馏水洗涤干净,并用各待盛溶液润洗。
D.将物质的量浓度为M mol/L的标准NaOH溶液装入碱式滴定管,调节液面记下开始读数为V1mL。
E.在锥形瓶下垫一张白纸,滴定至恰好反应为止,记下读数为V2mL。
F.把锥形瓶移到碱式滴定管下小心滴入NaOH标准溶液,边滴边摇动锥形瓶。
G.用某仪器准确量取浓硫酸样品10.00 mL,在烧杯中用蒸馏水溶解。
就此实验操作完成下列填空:
(1)正确操作步骤的顺序(用编号字母填写) → A → → → → → 。
(2)用来量取10.00mL浓硫酸的仪器是 。
(3)滴定中可选用的指示剂是 ;滴定中,目光应注视 ;
判断滴定恰好完成的依据是 ;读数时,目光与凹液面的最低处保持水平。
(4)某学生实验时用稀硫酸润洗了锥形瓶,测定的浓度会 (填“偏高”、“偏低”或“不变”)。
(5)该浓硫酸样品浓度的计算式为 。
 智慧小复习系列答案
智慧小复习系列答案科目:高中化学 来源: 题型:
有一支25mL酸式滴定管中盛盐酸,液面恰好在a mL刻度处,把管内液体全部放出,盛入量筒内,所得液体体积一定是
A.a mL B.(25-a) mL C.大于(25-a)mL D.大于a mL
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法错误的是
A.H2SO4、H2O、Cu是电解质
B.生石灰与水混合发生化学、物理变化
C.丁达尔效应可以区分溶液与胶体
D.漂白粉属于混合物
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子在碱性溶液中能大量共存,并且溶液为无色透明的是
A.Na+、Cu2+ 、SO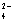 、OH— B.K+、Ba2+、Cl—、NO3—
、OH— B.K+、Ba2+、Cl—、NO3—
C.Na+、Cl—、Ca2+、MnO4— D.Na+、HCO3—、SO42—、Cl—
查看答案和解析>>
科目:高中化学 来源: 题型:
在酸性溶液中,能大量共存的离子组是( )
A.Mg2+、Fe3+、 、SCN- B.Al3+、Fe2+、Cl-、
、SCN- B.Al3+、Fe2+、Cl-、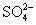
C.K+、Na+、Cl-、 D.Na+、Ba2+、
D.Na+、Ba2+、 、
、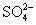
查看答案和解析>>
科目:高中化学 来源: 题型:
请回答:
(1)从能量角度看,断开化学键吸收能量,形成化学键 能量;则反应:H2(g)+ Cl2(g)=2HCl(g)的△H= (已知键能:H—H为436kJ/mol;Cl—Cl为243 kJ/mol;H—Cl为431 kJ/mol)。
(2)将含1mol/L稀H2SO4与略过量的1mol/LNaOH溶液按体积比1L与2L中和,测得放热114.6kJ,则强酸与强碱反应的中和热的数值为 kJ/mol。
(3)某小组用KMnO4酸性溶液与H2C2O4(有还原性)溶液反应,以溶液紫色消失快慢的方法,研究影响反应速率的因素。请完成以下实验设计表:
| 实验编号 | T/K | 催化剂的用量/ g | 酸性KMnO4溶液的浓度/mol·L-1 | 实验目的 |
| ① | 298 | 0.5 | 0.010 | a. 实验①和②探究酸性KMnO4溶液的浓度对该反应速率的影响; b. 实验①和 探究温度对反应速率的影响; c. 实验①和④探究 对反应速率的影响。 |
| ② | 0.5 | 0.001 | ||
| ③ | 323 | 0.010 | ||
| ④ | 298 | 0 | 0.010 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com