
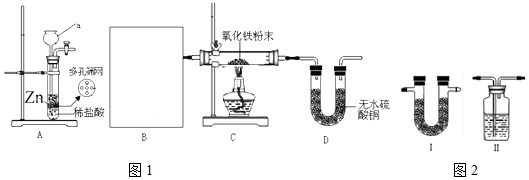
 .实验结束时应该采取的操作是先停止加热,冷却到室温,再停止通H2.
.实验结束时应该采取的操作是先停止加热,冷却到室温,再停止通H2. 分析 ①根据实验室常用仪器解答;A装置制得H2中有HCl和H2O杂质,应选择盛有碱石灰的U形管进行除杂和干燥;
②先计算出浓盐酸的物质的量浓度c=$\frac{1000ρw}{M}$,然后根据溶液稀释前后物质的量不变计算所需浓盐酸的体积;
③该反应中Zn元素化合价由0价变为+2价、H元素化合价由+1价变为0价,其转移电子数为2,根据先撤导管后熄灭酒精灯,防止水倒吸考虑.
解答 解:①据图可知仪器a是长颈漏斗,H2与氧化铁反应之前一定要干燥,否则达不到所需温度,A装置制得H2中有HCl和H2O杂质,应选择盛有碱石灰的U形管,
故答案为:I,碱石灰;
②浓盐酸的物质的量浓度为c=$\frac{1000ρw}{M}$=$\frac{1000×1.2×36.5%}{36.5}$mol/L=12mol/L,设所需浓硫酸的体积为V,则有V×12mol/L=O.5L×0.5mol/L,
则V=$\frac{0.5L×0.5mol/L}{12mol/L}$=O.0208L=20.8mL,
故答案为:20.8;
③该反应中为氢气还原氧化铁生成铁和水,其转移电子数为6,所以其转移电子方向和数目为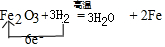 ,
,
H2还原氧化铁的实验结束时,先停止加热,冷却到室温,再停止通H2,防止生成的铁被氧化.
故答案为: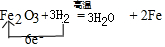 ;先停止加热,冷却到室温,再停止通H2.
;先停止加热,冷却到室温,再停止通H2.
点评 本题考查物质的量浓度的有关物理量计算,氧化还原反应中注转移电子方向和数目,意转移电子守恒的灵活运用,实验仪器的名称及除杂干燥装置的选择,题目难度不大.


 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案科目:高中化学 来源: 题型:解答题
| 化学式 | AgCl | AgBr | AgI | Ag2S | Ag2CrO4 |
| 颜色 | 白色 | 浅黄色 | 黄色 | 黑色 | 红色 |
| Ksp | 1.8×10-10 | 5.0×10-13 | 8.3×10-17 | 2.0×10-48 | 1.8×10-10 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (Q1+Q2+Q3) kJ | B. | 0.5(Q+Q2+Q3) kJ | ||
| C. | (0.5Q1-1.5Q2+0.5Q3) kJ | D. | -(3Q1-Q2+Q3) kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(A)=0.9 mol/(L•s) | B. | v(B)=0.5 mol/(L•s) | C. | v(C)=1.4 mol/(L•s) | D. | v(D)=1.8 mol/(L•s) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KClO3在反应中得到电子 | |
| B. | ClO2中氯的化合价为+4价 | |
| C. | 在反应中H2C2O4是还原剂 | |
| D. | 1 mol KClO3参加反应有2mol电子转移 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
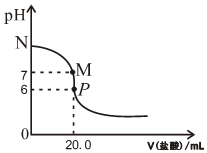 298K时,在20.0mL0.20mol•L-1氨水中滴入0.20mol•L-1的盐酸,溶液的pH与所加盐酸的体积关系如图所示.
298K时,在20.0mL0.20mol•L-1氨水中滴入0.20mol•L-1的盐酸,溶液的pH与所加盐酸的体积关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,a L的氧气和氮气的混合物含有的分子数约为$\frac{a}{22.4}$×6.02×1023 | |
| B. | 由1L 1 mol•L-1的 FeCl3溶液制成的胶体中胶粒总数小于NA个 | |
| C. | 2.3g金属钠变为钠离子失去0.1NA电子 | |
| D. | 2.24L CO2中含有的原子数为3×0.1×6.02×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com