
| A. | 放热反应在任意条件下都能自发进行 | |
| B. | 已知热化学方程式2A(g)+B(g)?2C (g)△H=-QkJ/mol (Q>0)将2molA(g)和1molB(g)置于一密闭容器中充分反应后放出QkJ的热量 | |
| C. | 1mol/L的盐酸与1mol/L的氨水、11mol/L的NaOH溶液等体积混合,充分反应,后者比前者放出的热量多 | |
| D. | BaCl2溶液中加过量H2SO4,溶液中一定不存在Ba2+ |
分析 A.反应能否自发进行取决于△H-T△S数值的大小,与反应条件无关,放热和熵增加有利反应自发进行;
B.反应是可逆反应不能进行彻底;
C.1mol/L的氨水溶液中存在电离平衡,电离是吸热过程;
D.硫酸钡是难溶的沉淀,但溶液中存在沉淀溶解平衡;
解答 解:A.依据△H-T△S<0的反应才能自发进行,反应能否自发进行不只是受焓变一个因素决定,若△H<0,△S<0,高温下△H-T△S>0,故A错误;
B.已知热化学方程式2A(g)+B(g)?2C (g)△H=-QkJ/mol (Q>0)将2molA(g)和1molB(g)置于一密闭容器中充分反应后,反应是可逆反应不能进行彻底,所以放出的热量<QkJ,故B错误;
C.一水合氨是弱碱存在电离平衡,电离过程是吸热过程,1mol/L的盐酸与1mol/L的氨水、11mol/L的NaOH溶液等体积混合,充分反应,后者比前者放出的热量多,故C正确;
D.BaCl2溶液中加过量H2SO4,反应生成硫酸钡沉淀,硫酸钡存在沉淀溶解平衡,则溶液中一定存在Ba2+,故D错误;
故选C.
点评 本题考查了反应自发进行的判断依据、化学反应能量的变化、弱电解质电离平衡影响因素,注意溶解沉淀平衡的理解,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 浓烧碱溶液中加入铝片:A1+2OH-+2H2O═[A1(OH)4]-+H2↑ | |
| B. | 澄清石灰水与少量小苏打溶液混合:Ca2++OH-+HCO3一═CaCO3↓+H2O | |
| C. | 食醋和小苏打溶液混合;CH3COOH+HCO3一═CH3COO-十H2O+CO2↑ | |
| D. | 敞开体系,向FeC12溶液滴加NaOH溶液:4Fe2++8OH-+O2+2H2O═4Fe (OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 新型材料聚酯纤维、光导纤维都属于有机高分子 | |
| B. | 14C可用于文物年代的鉴定,14C与12C互为同素异形体 | |
| C. | 凡含有添加剂的食物对人体健康均有害,不宜食用 | |
| D. | “开发利用新能源”、“汽车尾气催化净化”都能提高空气质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
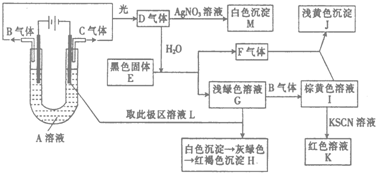
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质发生化学反应时必然伴随着能量变化 | |
| B. | 金属铜导电,故金属铜是电解质 | |
| C. | 自发反应都是熵增大的反应 | |
| D. | 增大反应物浓度,可增大单位体积内活化分子的百分数,从而使反应速率增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应的还原剂是NH4+ | |
| B. | 消耗1mol氧化剂,转移2mol电子 | |
| C. | 氧化剂与还原剂的物质的量之比是2:3 | |
| D. | 反应后溶液酸性明显增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 减小压强 | B. | 升高温度 | C. | 增加SO2浓度 | D. | 加入催化剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com