
硫酸亚锡(SnSO4)是一种重要的硫酸盐,主要用于电镀工业的镀锡、铝合金表面的氧化着色、印染工业的媒染剂、双氧水去除剂等。某研究小组设计SnSO4制备路线如下:

查阅资料:
Ⅰ.酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式,Sn2+易被氧化。
Ⅱ.SnCl2易水解生成难溶物Sn(OH)Cl(碱式氯化亚锡)。
请回答下列问题:
(1)SnCl2粉末需加浓盐酸进行溶解,请用平衡移动原理解释原因 。
(2)加入Sn粉的作用有两个:①调节溶液pH ② 。
(3)反应Ⅰ生成的气体为CO2,得到的沉淀是SnO。该沉淀经过滤后需漂洗,如何证明沉淀已经洗涤完全? 。
(4)多步操作包含的具体实验步骤的名称可以是: 。
(5)酸性条件下,SnSO4还可以用作双氧水去除剂,发生反应的离子方程式是 。
(6)该小组通过下列方法测所用锡粉样品的纯度(杂质不参与反应):
①将试样溶于盐酸中,发生的反应为:Sn + 2HCl→SnCl2 + H2↑;
②加入过量的FeCl3 ;
③用已知浓度的K2Cr2O7滴定生成的Fe2+,发生的反应为:6FeCl2 + K2Cr2O7 + 14HCl →6FeCl3 + 2KCl + 2CrCl3 +7H2O
取1. 226 g 锡粉样品,经上述各步反应后,共用去0.1000 mol/L K2Cr2O7溶液32.00 mL。则该锡粉样品中锡的质量分数是
(1)加入盐酸,使水解平衡向左移动,抑制Sn2+水解
(2)防止Sn2+被氧化
(3)取最后一次洗涤液,向其中加入AgNO3溶液,若无沉淀,则说明已洗涤干净
(4)加热浓缩、冷却结晶、过滤、洗涤
(5)Sn2+ + H2O2 +2H+=Sn4+ +2H2O
(6)93.18%
【解析】
试题分析:(1)SnCl2在水中发生水解反应:SnCl2+H2O Sn(OH)Cl+HCl. 生成难溶物Sn(OH)Cl,使溶液变浑浊。若加入HCl,可使平衡向逆反应方向移动,抑制Sn2+水解。
Sn(OH)Cl+HCl. 生成难溶物Sn(OH)Cl,使溶液变浑浊。若加入HCl,可使平衡向逆反应方向移动,抑制Sn2+水解。
(2)由于在酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式,Sn2+易被氧化。为了调节调节溶液pH并防止Sn2+被氧化为Sn4+要加入Sn粉。
(3)在反应过程中加入了HCl,沉淀的表面会有Cl-存在,只要能证明在洗涤液中无Cl-存在就可以证明沉淀已经洗涤完全。具体的检验方法是取最后一次洗涤液,向其中加入AgNO3溶液,若无沉淀,则说明已洗涤干净。
(4)在多步操作中所包含的具体实验步骤的名称是加热浓缩、冷却结晶、过滤、洗涤。
(5)酸性条件下,SnSO4与双氧水发生反应的离子方程式是Sn2+ + H2O2 +2H+=Sn4+ +2H2O。
(6)在处理过程中发生的反应为:Sn + 2HCl=SnCl2 + H2↑;2FeCl3+SnCl2=2FeCl2+ SnCl4
6FeCl2 + K2Cr2O7 + 14HCl =6FeCl3 + 2KCl + 2CrCl3 +7H2O。由方程式得关系式3Sn—3SnCl2 —6FeCl3 — K2Cr2O7.因为n(K2Cr2O7)=C·V=0.1000 mol/L×0.032L=3.2×10-3mol.所以n(Sn)= 3×3.2×10-3mol =9.6 × 10-3mol.m(Sn)=n·M=9。6×10-3mol×119g/mol=1.14g. 该锡粉样品中锡的质量分数是(1.14g÷1. 226 g) ×100%=93.18%.
考点:考查在电镀工业的镀锡、铝合金表面的氧化着色、印染工业的媒染剂、双氧水去除剂等有重要作用的SnSO4制备、性质反应原理等的知识。


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源:2013-2014学年山东省淄博市高三3月模拟考试理综化学试卷(解析版) 题型:填空题
硫酸亚锡(SnSO4)、四氯化锡(SnCl4)常用于印染和电镀工业。
(1)某研究小组设计SnSO4制备路线如下:

已知:酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式,Sn2+易被氧化;SnCl2极易水解。
①SnCl2酸溶后加入Sn粉的作用是??????????????????????? 。
②步骤Ⅱ中用到的玻璃仪器除烧杯外还有????????????? ;步骤Ⅳ中需要洗涤固体SnO中含有的杂质,检验SnO中的Cl-是否洗涤干净的操作为???????????????? 。
③步骤Ⅴ涉及到的操作有:a.过滤? b.洗涤? c.蒸发浓缩? d.冷却结晶? e.低温干燥,则其正确的操作顺序为??????????????????????? 。
(2)实验室拟用以下装置,用熔融的金属锡与干燥纯净的氯气制取无水SnCl4(SnCl4熔点-33℃,沸点114.1℃,遇潮湿空气极易水解),此反应过程放出大量的热。
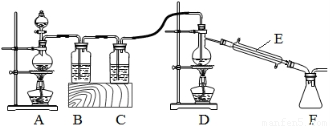
①装置C中应加入试剂为___________;仪器E的名称为____________________。
②反应开始生成SnCl4时,可以先熄灭___(填字母序号)处的酒精灯,理由是________。
③该实验装置设计尚存在缺陷,改进的方法是(包括仪器、试剂及连接位置等)______________。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年安徽省“江南十校”高三3月联考理综化学试卷(解析版) 题型:填空题
硫酸亚锡(SnSO4)是一种重要的能溶于水的硫酸盐,广泛应用于镀锡工业。某研究小组
设计SnSO4制备路线如下:
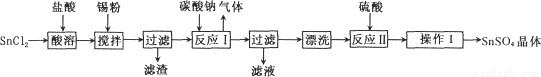
查阅资料:
I.酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式,Sn2+易被氧化。
Ⅱ.SnC12易水解生成碱式氯化亚锡[Sn(OH)Cl]
回答下列问题:
(1)操作l的步骤为 ____、____、过滤、洗涤、干燥。对沉淀进行洗涤的方法是_____________。
(2) SnCl2粉末需加浓盐酸进行溶解,请结合必要的化学方程式用平衡移动原理解释原因:________。
(3)加入Sn粉的作用有两个:①调节溶液pH;②__________。
(4)酸性条件下,SnSO4还可以用作双氧水去除剂,发生反应的离子方程式是:________________。
(5)该小组通过下列方法测定所用锡粉的纯度(杂质不参与反应):取ag锡粉溶于盐酸中,向生成的SnC12中加入过量的FeC13溶液,用b mol/LK2Cr2O7滴定生成的Fe2+(已知酸性环境下,Cr2O72-可被还原为Cr3+),共用去K2Cr2O7溶液m ml。则锡粉中锡的质量分数是________。(Sn的摩尔质量为M g/mol,用含a、b、m、M的代数式表示)
查看答案和解析>>
科目:高中化学 来源:2013-2014学年广东省惠州市高三第三次调研考试化学试卷(解析版) 题型:填空题
硫酸亚锡(SnSO4)可用于镀锡工业.某小组设计SnSO4制备路线为:

查阅资料:
Ⅰ.酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式,Sn2+易被氧化.
Ⅱ.SnCl2易水解生成碱式氯化亚锡
(1)锡原子的核电荷数为50,与碳元素同处ⅣA族,锡位于周期表的第 周期(1分)
(2)操作Ⅰ是 过滤、洗涤等(2分)
(3)溶解SnCl2粉末需加浓盐酸,原因是
(4)加入Sn粉的作用有两个:①调节溶液pH ②
(5)反应Ⅰ得到沉淀是SnO,得到该沉淀的离子反应方程式是
(6)酸性条件下,SnSO4与双氧水去反应的离子方程式是
(7)该小组通过下列方法测定所用锡粉的纯度(杂质不参与反应):
①将试样溶于盐酸中,发生的反应为:Sn+2HCl═SnCl2+H2↑;
②加入过量的FeCl3;
③用已知浓度的K2Cr2O7滴定②生成的Fe2+,再计算锡粉的纯度,请配平方程式:
FeCl2 + K2Cr2O7
+ HCl = FeCl3
+ KCl + CrCl2+

查看答案和解析>>
科目:高中化学 来源:2013-2014学年山东省济宁市高三上学期期末考试化学试卷(解析版) 题型:实验题
硫酸亚锡(SuSO4)是一种重要的硫酸盐,广泛应用于镀锡工业。某研究小组设计SnSO4制备路线如下:
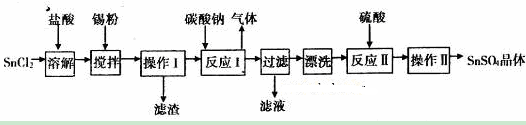
查阅资料:
I.酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式,Sn2+易被氧化。
II.SnC12易水解生成碱式氯化亚锡[Sn(OH)Cl]。
回答下列问题:
(1)SnC12粉末需要加浓盐酸进行溶解,请用化学方程式说明原因___________________。
(2)在SnC12溶液中加入Sn粉的作用有两个:①调节溶液pH ②_________________。
(3)操作I中使用的玻璃仪器有___________________。
(4)该小组通过下列方法测定所用锡粉的纯度(杂质不参与反应):
①将试样溶于盐酸中,发生的反应为:Sn+2HCl═SnCl2+H2↑;
②加入过量的FeCl3,发生的反应为:SnCl2+ FeCl3= SnCl4+ FeCl2
③用已知浓度的K2Cr2O7滴定生成的Fe2+,发生的反应为:6FeCl2+K2Cr2O7+14HCl═6FeCl3+2KCl+2CrCl3+7H2O
滴定时,K2Cr2O7溶液应该装在____________(填“酸式”或“碱式”)滴定管中。
若取2.0g锡粉,经上述各步反应后,共用去0.100mol/L K2Cr2O7溶液40.00mL,锡粉中锡的质量分数是____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com