
| 元素代号 | 相关信息 |
| T | T 的单质能与冷水剧烈反应,所得强碱性溶液中含有两种电子数相同的阴、阳离子 |
| X | X 的原子最外层电子数是其内层电子数的三倍 |
| Y | 在第三周期金属元素中,Y 的简单离子半径最小 |
| Z | T、X、Z 组成的 36 电子的化合物 A 是家用消毒剂的主要成分 |

分析 短周期主族元素中,T 的单质能与冷水剧烈反应,所得强碱性溶液中含有两种电子数相同的阴、阳离子,则T为Na;X 的原子最外层电子数是其内层电子数的三倍,最外层电子数不超过8,原子只能有2个电子层,最外层电子数为6,故X为O元素;在第三周期金属元素中,Y 的简单离子半径最小,则Y为Al;T、X、Z 组成的 36 电子的化合物 A 是家用消毒剂的主要成分,则A为NaClO,Z为Cl.
解答 解:短周期主族元素中,T 的单质能与冷水剧烈反应,所得强碱性溶液中含有两种电子数相同的阴、阳离子,则T为Na;X 的原子最外层电子数是其内层电子数的三倍,最外层电子数不超过8,原子只能有2个电子层,最外层电子数为6,故X为O元素;在第三周期金属元素中,Y 的简单离子半径最小,则Y为Al;T、X、Z 组成的 36 电子的化合物 A 是家用消毒剂的主要成分,则A为NaClO,Z为Cl.
(1)Z为Cl 元素,在周期表中的位置:第三周期第ⅦA 族,
故答案为:第三周期第ⅦA 族;
(2)T、X、Y 元素简单离子分别为Na+、O2-、Al3+,电子层结构相同的离子,核电荷数越大离子半径越小,故离子半径由大到小的顺序为:O2->Na+>Al3+,
故答案为:O2->Na+>Al3+;
(3)已知 1mol 化合物 NaClO 与 Na2SO3在溶液中发生反应时,转移 2mol 电子,则Cl元素被还原为Cl-,该反应的离子方程式:ClO-+SO32-=Cl-+SO42-,
故答案为:ClO-+SO32-=Cl-+SO42-;
(4)①由图可知,同周期内,随着原子序数的增大,元素的气态原子失去最外层一个电子所需能量E值变化的总趋势是:随着原子序数的递增,E 值增大,
故答案为:随着原子序数的递增,E 值增大;
②根据如图提供的信息,可知随着原子序数的递增,E 值增大,可推断E氟>E氧,
故答案为:>.
点评 本题以元素推断为载体,考查结构与位置关系、微粒半径比较、氧化还原反应、元素周期律等,较好的考查学生对知识的迁移运用、分析归纳能力,难度中等.


科目:高中化学 来源: 题型:实验题
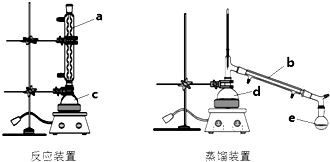
 CH3COOCH2CH3+H2O.
CH3COOCH2CH3+H2O.| 物质 | 98.3%浓硫酸 | 乙酸乙酯 | 乙酸 | 乙醇 | 乙醚 | 水 |
| 沸点 | 338℃, | 77.1℃ | 118℃ | 78.5℃ | 34.6℃ | 100℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
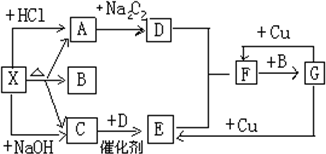 如图中的每一个方格表示有关的一种反应物或生成物,其中X为正盐,A能使澄清石灰水变浑浊的无色气体,C是能使湿润的红色的石蕊试纸变蓝的无色气体,
如图中的每一个方格表示有关的一种反应物或生成物,其中X为正盐,A能使澄清石灰水变浑浊的无色气体,C是能使湿润的红色的石蕊试纸变蓝的无色气体,查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过滤、结晶、灼烧、萃取、分液和蒸馏等都是常用的分离有机混合物的方法 | |
| B. | 在中和热的测定实验中,将氢氧化钠溶液迅速倒入盛有盐酸的量热计中,立即读出并记录溶液的起始温度,充分反应后再读出并记录反应体系的最高温度 | |
| C. | 实验室用已知浓度的醋酸溶液滴定未知浓度的氢氧化钠溶液时,选用酚酞做指示剂比用甲基橙做指示剂时带来的误差要小一些 | |
| D. | 溶液配制、中和滴定实验中,容量瓶、锥形瓶用蒸馏水洗净后即可使用;而滴定管、移液管用蒸馏水洗净后,须再用待盛液润洗2~3次后方可使用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 阳极反应式为:Ce2O3-2e-+6H+═2Ce4++3H2O | |
| B. | 电解时溶液中的阳离子向阳极移动 | |
| C. | 如果阴极液是稀硫酸,电极反应式为:2H++2e-═H2↑ | |
| D. | 如果阴极液是钠、镁、铜、镍、锰、锌等的硫酸盐溶液,则在阴极室可得到铜、镍、锌、锰等金属合金粉末 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气有氧化性,作用于正常细胞而癌化 | |
| B. | 氯水中的次氯酸具有杀菌性,氧化了正常细胞,异化为癌细胞 | |
| C. | 氯气有毒,杀死正常细胞,不杀灭癌细胞 | |
| D. | 氯气作用于水中有机物,生成有机氯化合物而致癌 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ② | C. | ③④ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硝酸保存在无色的玻璃瓶中 | |
| B. | 氯水应保存在带橡胶塞的棕色细口瓶中 | |
| C. | 金属钠应保存在汽油中防止被氧化 | |
| D. | 保存硫酸亚铁溶液时可向里面加少量铁屑 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 强电解质在水溶液中的电离过程是不可逆的 | |
| B. | 强电解质的水溶液导电能力一定比弱电解质水溶液的导电能力强 | |
| C. | 易溶于水的电解质一定是强电解质 | |
| D. | 难溶于水的电解质一定是弱电解质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com