
【题目】下列变化中,需加入氧化剂才能实现的是
A.CaCO3→CaOB.CuO→CuC.Zn→ZnSO4D.H2O(g)→H2O(l)
科目:高中化学 来源: 题型:
【题目】用98%的浓硫酸(其密度为1.84g/cm3) 配制100mL 1.0molL﹣1稀硫酸实验步骤如下: ①计算所用浓硫酸的体积 ②量取一定体积的浓硫酸 ③溶解④检漏、转移、洗涤 ⑤定容、摇匀
若实验仪器有:A 100mL量筒 B 玻璃棒 C 50mL容量瓶 D 100mL容量瓶 E 10mL量筒 F 胶头滴管 G 50mL烧杯
回答下列问题:
(1)需量取浓硫酸的体积为mL.
(2)实验时不需选用的仪器有(填序号) .
(3)下列情况对所配制的稀硫酸浓度有何影响(用“偏大”、“偏小”或“无影响”填写)? A.所用的浓硫酸长时间放置在密封不好的容器中 .
B.容量瓶用蒸馏水洗涤后残留有少量的水 .
C.所用过的烧杯、玻璃棒未洗涤 .
D.定容时俯视溶液的凹液面 .
(4)检验所配制的溶液含有SO42﹣ 的操作是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电负性的说法中,不正确的是( )
A.元素的电负性越大,原子在化合物中吸引电子的能力越强
B.主族元素的电负性越大,元素原子的第一电离能一定越大
C.在元素周期表中,元素电负性从左到右呈现递增的趋势
D.形成化合物时,电负性越小的元素越容易显示正价
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E是化学中常见的物质,常温下,E是一种无色无味的液体,它们之间有如图反应关系. 
(1)若A是一种红色金属单质,B是一种常见的挥发性酸,反应时生成的C是无色气体,反应的离子方程式为 , 若反应放出1.12L气体(标准状况下),则被还原的B物质的量为mol.
(2)若实验室中利用固体A和B的反应制备气体C,C是一种无色、刺激性气味、密度比空气小、碱性的气体,试写出此反应的化学方程式;实验室检验C的方法为 .
(3)若B是黄绿色有毒气体,上述关系经常用于实验室尾气处理,则反应的离子方程式为 . 若用湿润的淀粉碘化钾试纸靠近盛满B的试管口,看到的现象为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关苯分子中的化学键描述正确的是( )
①每个碳原子的sp2杂化轨道中的其中一个形成大π键
②每个碳原子的未参加杂化的2p轨道形成大π键
③碳原子的三个sp2杂化轨道与其他原子形成三个σ键
④碳原子的未参加杂化的2p轨道与其他原子形成σ键
A.①②
B.②③
C.③④
D.①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知化学反应①: Fe(s)+CO2(g)═FeO(s)+CO(g),其平衡常数为K1;化学反应②:
Fe(s)+H2O(g)═FeO(s)+H2(g),其平衡常数为K2 . 在温度
973K和1173K情况下,K1、K2的值分别如下:
温度 | K1 | K2 |
973K | 1.47 | 2.38 |
1173K | 2.15 | 1.67 |
(1)通过表格中的数值可以推断:反应①是(填“吸热”或“放热”)反应.
(2)现有反应③:CO2(g)+H2(g)=CO(g)+H2O(g),请你写出该反应的平衡常数K3的数学表达式:K3= .
(3)根据反应①与②可推导出K1、K2与K3之间的关系式 . 据此关系式及上表数据,也能推断出反应③是(填“吸热”或“放热”)反应,要使反应③在一定条件下建立的平衡向正反应方向移动,可采取的措施有(填写序号). A.缩小反应容器容积 B.扩大反应容器容积
C.降低温度 D.升高温度
E.使用合适的催化剂 F.设法减少CO的量
(4)图甲、乙分别表示反应③在t1时刻达到平衡、在t2时刻因改变某个条件而发生变化的情况: ①图甲中t2时刻发生改变的条件是 .
②图乙中t2时刻发生改变的条件是 . 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀.Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用.阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用.某科研小组用电浮选凝聚法处理污水,设计装置示意图,如图所示. 
(1)实验时若污水中离子浓度较小,导电能力较差,产生气泡速率缓慢,无法使悬浮物形成浮渣.此时,应向污水中加入适量的 .
A.BaSO4
B.CH3CH2OH
C.Na2SO4
D.NaOH
(2)电解池阳极发生了两个电极反应,其中一个反应生成一种无色气体,则阳极的电极反应式分别是 Ⅰ.;
Ⅱ. .
(3)电极反应I和Ⅱ的生成物反应得到Fe(OH3)沉淀的离子方程式是 .
(4)该燃料电池是以熔融碳酸盐为电解质,CH4为燃料,空气为氧化剂,稀土金属材料做电极.为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时必须有部分A物质参加循环(见上图).A物质的化学式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组的同学查阅相关资料知氧化性:Cr2O72﹣>Fe3+ , 设计了盐桥式的原电池,见图.盐桥中装有琼脂与饱和K2SO4溶液.下列叙述中正确的是( ) 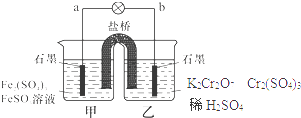
A.甲烧杯的溶液中发生还原反应
B.乙烧杯中发生的电极反应为:2Cr3++7H2O﹣6e﹣=Cr2O72﹣+14H+
C.外电路的电流方向是从b到a
D.电池工作时,盐桥中的SO42﹣ 移向乙烧杯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子数是内层电子数的3倍,下列说法中正确的是( ) 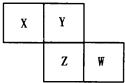
A.Z的单质与氢气反应较Y剧烈
B.X、Y形成的化合物都易溶于水
C.只由这四种元素不能组成有机化合物
D.最高价氧化物对应水化物的酸性W比Z弱
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com