
��13�֣���ҵ�Ͽ�����ú���������CO��H2���ϳɶ����ѣ�CH3OCH3��ͬʱ���ɶ�����̼����������Ӧ���£�
�� 2H2 (g)��CO(g)  CH3OH (g) ��H�� ��90.8 kJ��mol-1
CH3OH (g) ��H�� ��90.8 kJ��mol-1
�� 2CH3OH(g)  CH3OCH3(g)��H2O(g) ��H�� ��23.5 kJ��mol-1
CH3OCH3(g)��H2O(g) ��H�� ��23.5 kJ��mol-1
�� CO(g)��H2O(g)  CO2 (g)��H2(g) ��H�� ��41.3 kJ��mol-1
CO2 (g)��H2(g) ��H�� ��41.3 kJ��mol-1
��1���ܺϳɷ�Ӧ���Ȼ�ѧ����ʽΪ ��
��2��һ�������µ��ܱ������У������ܷ�Ӧ�ﵽƽ��ʱ��Ҫ���CO��ת���ʣ����Բ�ȡ�Ĵ�ʩ��_____������ĸ���ţ���
A ���¸�ѹ B ������� C ����CO2��Ũ��
D������CO��Ũ�� E�������������
��3����Ӧ��2CH3OH(g) CH3OCH3(g)��H2O(g)�����ֲ�ͬ�����½��У���Ӧ����Ϊ��ͬ�ĺ����ܱ�������CH3OCH3��H2O��ʼŨ��Ϊ0����CH3OH(g)��Ũ�ȣ�mol/L���淴Ӧʱ�䣨min���ı仯������±���
CH3OCH3(g)��H2O(g)�����ֲ�ͬ�����½��У���Ӧ����Ϊ��ͬ�ĺ����ܱ�������CH3OCH3��H2O��ʼŨ��Ϊ0����CH3OH(g)��Ũ�ȣ�mol/L���淴Ӧʱ�䣨min���ı仯������±���
ʵ�� ��� | �¶� Ũ�� ʱ�� | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
1 | 800�� | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
2 | 800�� | c2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
3 | 800�� | c3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
4 | 820�� | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
�����������ݣ����������գ�
��ʵ��1����Ӧ��10��20����ʱ������CH3OH(g)��ʾ��ƽ������Ϊ ��
��ʵ��2��CH3OH(g)�ij�ʼŨ��c2�� mol/L����Ӧ��20���Ӿʹﵽƽ�⣬���Ʋ�ʵ��2�л������������� ��
����ʵ��3�ķ�Ӧ����Ϊv3��ʵ��1�ķ�Ӧ����Ϊv1����v3 v1�����������������c3�� mol/L��
��13�֣�
��1��3H2(g)��3CO(g) CH3OCH3(g)��CO2 (g) ��H����246.4 kJ��mol-1��2�֣�
CH3OCH3(g)��CO2 (g) ��H����246.4 kJ��mol-1��2�֣�
��2�� C E ��2�֣�
��3����0.013mol/(L��min) ��2�֣�
��1.0��2�֣���������1�֣�
�ۣ���2�֣���1.2 mol/L��2�֣�
��������
�����������1���ܺϳɷ�Ӧ�Ļ�ѧ����ʽΪ3H2(g)��3CO(g) CH3OCH3(g)��CO2 (g) �����ݸ�˹���ɵ��ܷ�Ӧ=�١�2+��+�ۣ������ܷ�Ӧ���Ȼ�ѧ����ʽΪ3H2(g)��3CO(g)
CH3OCH3(g)��CO2 (g) �����ݸ�˹���ɵ��ܷ�Ӧ=�١�2+��+�ۣ������ܷ�Ӧ���Ȼ�ѧ����ʽΪ3H2(g)��3CO(g) CH3OCH3(g)��CO2 (g) ��H����246.4 kJ��mol-1��
CH3OCH3(g)��CO2 (g) ��H����246.4 kJ��mol-1��
��2��A���¶����ߣ�ƽ�������ƶ���CO��ת���ʽ��ͣ�����B�����������ƽ����Ӱ�죬CO��ת���ʲ��䣬����C�����ٶ�����̼��Ũ�ȣ�ƽ�������ƶ���CO��ת����������ȷ��D������CO��Ũ�ȣ���Ȼƽ�������ƶ�������CO��ת���ʽ��ͣ�����E������������ѣ�������Ũ�ȼ�С��ƽ�������ƶ���CO��ת�������ߣ���ȷ����ѡCE��
��3����ʵ��1����Ӧ��10��20����ʱ������CH3OH(g)��Ũ�ȼ���0.80-0.67=0.13mol/L�������ü״���ʾ��ƽ������Ϊ0.13mol/L/10min=0.013 mol/(L��min)��
��ʵ��2��ʵ��1���¶���ͬ���ﵽ��ƽ��״̬��ͬ������ͬ���Ǵﵽƽ���ʱ��̣�����ʵ��2�еļӳɵ���ʼŨ����ʵ��1��ͬ������1.0mol/L��ʵ��2�ķ�Ӧ���ʿ죬��ƽ��δ�ı䣬����������������ʵ��2ʹ���˴�����
�۸��ݱ������ݿ�֪ʵ��3ƽ��ʱCH3OH(g)Ũ�ȴ���ʵ��1����ʵ��3�ļ״�����ʼŨ�ȴ���ʵ��1����Ӧ��Ũ������Ӧ���ʼӿ죬����v3>v1��2CH3OH(g) CH3OCH3(g)��H2O(g)�Ƿ�Ӧǰ���������ʵ�������Ŀ��淴Ӧ�����Ժ��º��������´ﵽ��ƽ���ǵ�Чƽ�⣬ʵ��3�м״�ƽ��Ũ����ʵ��1��0.6/0.5=1.2��������ʼŨ��Ҳ��ʵ��1��1.2��������c3��1.2mol/L��
CH3OCH3(g)��H2O(g)�Ƿ�Ӧǰ���������ʵ�������Ŀ��淴Ӧ�����Ժ��º��������´ﵽ��ƽ���ǵ�Чƽ�⣬ʵ��3�м״�ƽ��Ũ����ʵ��1��0.6/0.5=1.2��������ʼŨ��Ҳ��ʵ��1��1.2��������c3��1.2mol/L��
���㣺���黯ѧƽ�����۵�Ӧ�ã�ƽ��ļ��㣬��Чƽ����жϣ���˹���ɵ�Ӧ��


 ���Ǽ���С����ϵ�д�
���Ǽ���С����ϵ�д� �Ͻ�ƽ���Ȿϵ�д�
�Ͻ�ƽ���Ȿϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ���㽭ʡ�߶���ѧ�����п��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
��֪��C(s)+H2O(g) CO(g)+H2(g) ��H = +130 kJ��mol-1
CO(g)+H2(g) ��H = +130 kJ��mol-1
2C(s)+O2(g) 2CO(g) ��H=a kJ��mol-1
2CO(g) ��H=a kJ��mol-1
H��H��O O��O��H���ļ��ֱܷ�Ϊ436 kJ��mol-1��496 kJ��mol-1��462 kJ��mol-1,��aΪ
O��O��H���ļ��ֱܷ�Ϊ436 kJ��mol-1��496 kJ��mol-1��462 kJ��mol-1,��aΪ
A��-332 B��-118 C��-220 D��+350
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ���㽭ʡ���������ѧУ�߶���ѧ�����л�ѧ�Ծ��������棩 ���ͣ�ѡ����
������ʵ��������������ԭ�����͵���
A���¶ȿ�����500�������ںϳɰ���Ӧ
B�����ű���ʳ��ˮ���ռ�Cl2
C����̼�����ϻ��д�������ð��
D����ҵ��ȡ������Na(l)+KCl(l) NaCl(l)+K(g)ѡȡ���˵��¶ȣ�ʹ�س������ӷ�Ӧ������з������
NaCl(l)+K(g)ѡȡ���˵��¶ȣ�ʹ�س������ӷ�Ӧ������з������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ���㽭̨����ѧ�߶���ѧ�ڵ�һ��ͳ����ѧ�Ծ��������棩 ���ͣ�ѡ����
�ò��缫���һ������ijŨ�ȵ�CuSO4��һ��ʱ���ֹͣ��⡣����ʱ����19.6gCu(OH)2��������Һǡ����ԭ��Һ��ȫ��ͬ��������˵������ȷ���ǣ� ��
A��ԭ��Һ�����ʵ�����Ϊ32g
B����������ת�Ƶ��ӵ����ʵ���Ϊ0.8mol
C�������������������������ڱ�״���µ����Ϊ4.48L
D�����գ������õ������������������õ���������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ���㽭̨����ѧ�߶���ѧ�ڵ�һ��ͳ����ѧ�Ծ��������棩 ���ͣ�ѡ����
��������������пa��b�ֱ���������ϡ���ᣬͬʱ��a�м�������CuSO4��Һ����ͼ�в������������V(L)��ʱ��t(min)�Ĺ�ϵ��������ȷ���ǣ� ��
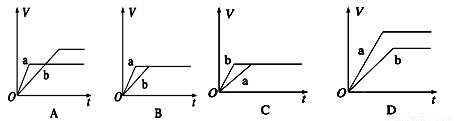
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�����۳���ص�һ���и߶��ϵ�һ�ο��Ի�ѧ��B���Ծ��������棩 ���ͣ�ѡ����
��һ���¶��£�������X������Y��0.16mol����10L�����ܱ������У�������Ӧ
X(g)��Y(g) 2Z(g) ��H��0��һ��ʱ���ﵽƽ�⣬��Ӧ�����вⶨ����������
2Z(g) ��H��0��һ��ʱ���ﵽƽ�⣬��Ӧ�����вⶨ����������
����
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
����˵����ȷ����
A�����¶��´˷�Ӧ��ƽ�ⳣ��K��1.44
B�������������䣬�����¶ȣ���Ӧ�ﵽ��ƽ��ǰ��(��)����(��)
C����Ӧǰ2min��ƽ�����ʦ�(Z)��2.0��10��3mol��L��1��min-1
D�������������䣬�ٳ���0.2mol Z��ƽ��ʱX�������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�����۳���ص�һ���и߶��ϵ�һ�ο��Ի�ѧ��B���Ծ��������棩 ���ͣ�ѡ����
��ͼ��ʾ��Һ��c(OH��)��c(H��)�Ĺ�ϵ�������жϴ�����ǣ� ��
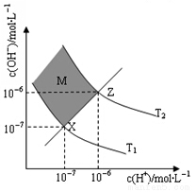
A������������������c(H��)��c(OH��)��Kw
B��M��������������c(H��)��c(OH��)
C��ͼ��T1��T2
D��XZ������������pH��7
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�����۳���ص�һ���и߶��ϵ�һ�ο��Ի�ѧ��A���Ծ��������棩 ���ͣ�ѡ����
����ˮ���������H+Ũ��Ϊ1��10��13mol/L����Һ�У�һ���ܴ����������������
�� K+��Cl����NO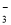 ��S2�� ��K+��Fe2+��I����SO
��S2�� ��K+��Fe2+��I����SO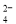 �� Na+��Cl����NO
�� Na+��Cl����NO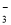 ��SO
��SO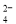
��Na+��Ca2+��Cl����HCO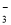 �� K+��Ba2+��Cl����NO
�� K+��Ba2+��Cl����NO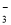
A���٢� B���ۢ� C���ۢ� D���ڢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�����۳���ص�һ���и�һ�ϵ�һ�ο��Ի�ѧ��A���Ծ��������棩 ���ͣ�ѡ����
��V L Fe2(SO4)3��Һ�У�����W g Fe3+������Һ��SO �����ʵ���Ũ���ǣ� ��
�����ʵ���Ũ���ǣ� ��
A��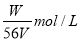 B��
B��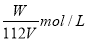 C��
C��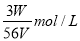 D��
D��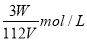
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com