
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
分析 (1)3mol氢气完全反应放出92.4kJ热量,则放出热量46.2kJ时消耗氢气物质的量=$\frac{46.2kJ}{92.5kJ}×3mol$=1.5mol,氢气反应速率=$\frac{\frac{△n}{V}}{△t}$;
(2)①该温度下,平衡常数为1,如果浓度商大于平衡常数,则平衡逆向移动,如果等于平衡常数,则平衡不移动,如果小于平衡常数,则平衡正向移动;
②该温度下,平衡常数为9,利用平衡常数计算参加反应的CO浓度,再利用转化率公式计算CO转化率;
③平衡正向移动且不是通过加入反应物时能提高氢气百分含量.
解答 解:(1)3mol氢气完全反应放出92.4kJ热量,则放出热量46.2kJ时消耗氢气物质的量=$\frac{46.2kJ}{92.5kJ}×3mol$=1.5mol,氢气反应速率=$\frac{\frac{△n}{V}}{△t}$=$\frac{\frac{1.5mol}{2L}}{5min}$=0.15molL-1min-1 或0.15mol/(Lmin),
故答案为:0.15molL-1min-1 或0.15mol/(Lmin);
(2)①该温度下,平衡常数为1,c(CO2)=c(H2)=0.5mol/L、c(CO)=c(H2O)=1mol/L,浓度商=$\frac{0.5×0.5}{1×1}$=0.25<1,则平衡正向移动,故答案为:正;
②温度下,平衡常数为9,设参加反应的CO的物质的量为xmol/L,
CO(g)+H2O(g)?H2(g)+CO2(g)
开始0.02mol/L0.02mol/L 0 0
反应xmol/L xmol/L xmol/L xmol/L
平衡(0.02-x)mol/L(0.02-x)mol/L xmol/L xmol/L
所以平衡常数K=$\frac{x.x}{(0.02-x).(0.02-x)}$=9,x=0.015,
转化率=$\frac{0.015mol/L}{0.02mol/L}$×100%=75%,
故答案为:75%;
③平衡正向移动且不是通过加入反应物时能提高氢气百分含量,
a.增加CO的物质的量,虽然平衡正向移动,但参加反应的CO小于加入的,导致氢气含量降低,故错误;
b.增加水蒸气的物质的量,虽然平衡正向移动,但参加反应的水蒸气小于加入的,导致氢气含量降低,故错误;
c.增大压强平衡不移动,则氢气含量不变,故错误;
d.降低温度,平衡正向移动,则氢气含量增大,故正确;
故选d.
点评 本题考查化学平衡计算,为高频考点,采用三段式法进行分析解答即可,难点是利用平衡常数判断平衡移动方向,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在A溶剂中,甲的酸性大于乙;在B溶剂中,甲的酸性可能小于乙 | |
| B. | HNO3在HClO4中是酸,在H2SO4中可能是碱 | |
| C. | 比较HCl,H2SO4,HClO4,HNO3酸性的强弱,用水肯定不能,用冰醋酸可能可以 | |
| D. | 比较HCN与HAc酸性的强弱,用水肯定可以,用液氨肯定也可以 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 取少量样品于试管,加水溶解,通入适量Cl2,再加KSCN溶液,观察现象 | |
| B. | 取少量样品于试管,加水溶解,加入NaOH溶液,露置于空气中,观察现象 | |
| C. | 取少量样品于试管,加水溶解,加入浓NaOH溶液并加热,用湿润的红色石蕊试纸置于试管口,观察试纸颜色的变化 | |
| D. | 取少量样品于试管,加水溶解,加入盐酸后再加入BaCl2溶液观察现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过氧化钠能用作供氧剂 | |
| B. | 氯化钠可用作净水剂 | |
| C. | 味精可用作食品添加剂 | |
| D. | 小苏打是一种膨松剂,可用于制作馒头和面包 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、Cu2+、Cl-、SO42- | B. | Na+、AlO2-、NO3-、CH3COO- | ||
| C. | Na+、NH4+、NO3-、S2- | D. | Na+、Ag+、NO3-、Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
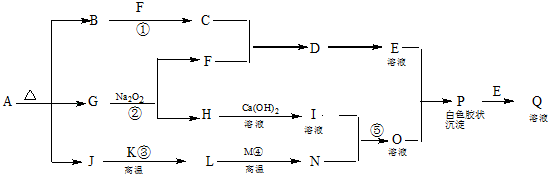
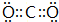 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2KClO3(s)═2KCl(s)+3O2(g);△H=-78.03kJ•mol-1:△S=494.4 J•mol-1•K-1 | |
| B. | CO(g)═C(s,石墨)+$\frac{1}{2}$O2(g);△H=110.5kJ•mol-1,△S=-89.4 J•mol-1•K-1 | |
| C. | 4Fe(OH)2(s)+2H2O(l)+O2(g)═4Fe(OH)3(s)△H=-444.3kJ•mol-1,△S=-280.1 J•mol-1•K-1 | |
| D. | NH4HCO3(s)+CH3COOH(aq)═CO2(g)+CH3COONH4(aq)+H2O(l);△H=37.30kJ•mol-1,△S=184.0 J•mol-1•K-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com