
���� ��һ���¶��£���2molA��2molB�����������Ϻ����ݻ�Ϊ2L��ij�ܱ������У�2minĩ��Ӧ�ﵽƽ��״̬��������0.8molD�������C��Ũ��Ϊ0.4mol/L������CΪ0.4mol/L��2=0.8mol����
3A��g��+B��g��?xC��g��+2D��g��
��ʼ����mol����2 2 0 0
�仯����mol����1.2 0.4 0.8 0.8
ƽ������mol����0.8 1.6 0.8 0.8
��1�����ʵ���֮�ȵ��ڻ�ѧ������֮�ȣ���x=2��
��2��A��ת����=$\frac{ת����A�����ʵ���}{A����ʼ���ʵ���}$��100%��
��3������v=$\frac{��c}{��t}$����v��D����
��4��C���������=$\frac{C�����ʵ���}{������������ʵ���}$��
��5���ɣ�1����֪��Ӧǰ����������ʵ������䣬���º����£�����ѧ������ת������ߣ�����n��A����n��B��=2mol��2mol=1��1���ɣ�
��� �⣺��һ���¶��£���2molA��2molB�����������Ϻ����ݻ�Ϊ2L��ij�ܱ������У�2minĩ��Ӧ�ﵽƽ��״̬��������0.8molD�������C��Ũ��Ϊ0.4mol/L������CΪ0.4mol/L��2=0.8mol����
3A��g��+B��g��?xC��g��+2D��g��
��ʼ����mol����2 2 0 0
�仯����mol����1.2 0.4 0.8 0.8
ƽ������mol����0.8 1.6 0.8 0.8
��1�����ʵ���֮�ȵ��ڻ�ѧ������֮�ȣ�����0.8mol��0.8mol=x��2�����x=2���ʴ�Ϊ��2��
��2��A��ת����=$\frac{1.2mol}{2mol}$��100%=60%���ʴ�Ϊ��60%��
��3��v��D��=$\frac{\frac{0.8mol}{2L}}{2min}$=0.2mol/��L��min�����ʴ�Ϊ��0.2mol/��L��min����
��4��C���������=$\frac{0.8mol}{4mol}$=20%���ʴ�Ϊ��20%��
��5���÷�Ӧǰ����������ʵ������䣬���º����£�����ѧ������ת������ߣ�����n��A����n��B��=2mol��2mol=1��1���ɣ���ʼ����C��D��$\frac{4}{3}$mol���ɻ�ѧ����ʽ3A��g��+B��g��?2C��g��+2D��g����֪ת������ߣ����Եõ�AΪ$\frac{4}{3}$mol��$\frac{3}{2}$=2mol���õ�BΪ$\frac{4}{3}$mol��$\frac{1}{2}$=$\frac{2}{3}$mol���ʻ���Ҫ����B������B�����ʵ���Ϊ2mol-$\frac{2}{3}$mol=$\frac{4}{3}$mol��
�ʴ�Ϊ��B��$\frac{4}{3}$mol��
���� ���⿼�黯ѧƽ����йؼ��㡢Ӱ�컯ѧƽ������ء���Чƽ��ȣ��Ѷ��еȣ���5����ע�������Чƽ����ɣ�1�����º��ݣ���Ӧǰ������������ȣ�����ѧ������ת����һ�ߣ���Ӧ���������������Ӧǰ�����������ȣ�����ѧ������ת����һ�ߣ���Ӧ��������ȱȣ�2�����º�ѹ������ѧ������ת����һ�ߣ���Ӧ��������ȱȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��ҵ����ȡ�ֹ�Ļ�ѧ����ʽ��SiO2+2C$\frac{\underline{\;����\;}}{\;}$Si+2CO�� | |
| B�� | ������������γɻ��漰��Ӧ2H2SO3+O2$\frac{\underline{\;����\;}}{\;}$2H2SO4 | |
| C�� | Na2S2O3��Һ�м���ϡ���S2O32-+2H+�TSO2+S��+H2O | |
| D�� | ��֪����ƽ�ⳣ����H2CO3��HClO��HCO3-����NaClO��Һ��ͨ������CO2�� 2ClO-+CO2+H2O=2HClO+CO32- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
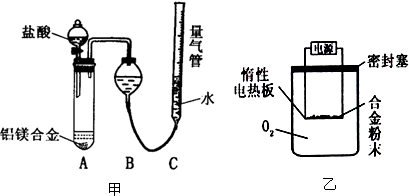
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 1 | B�� | 4 | C�� | 3 | D�� | 6 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ˮ�еĸ�բ�����ӵ�Դ�ĸ��� | B�� | ���¸ֹ�����п�� | ||
| C�� | ��ˮ������Ϳ�߷���Ĥ | D�� | ������������Ϳ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
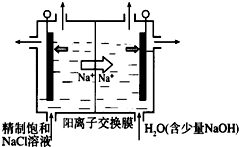 �������ȣ�ClO2��Ϊһ�ֻ���ɫ���壬�ǹ����Ϲ��ϵĸ�Ч�����ס����١���ȫ��ɱ����������
�������ȣ�ClO2��Ϊһ�ֻ���ɫ���壬�ǹ����Ϲ��ϵĸ�Ч�����ס����١���ȫ��ɱ�����������鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �����Ŵ�����ֹװ������ѻ���� | |
| B�� | �ʶȿ���ͨ�磬��ֽ���������������� | |
| C�� | ��רҵ���������Ա���м�� | |
| D�� | �ڸ���������ȵ��������õ�����«���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �������պ���ʱҪ���������н��� | |
| B�� | ����ʱ��ˮ���������ϲ�ͨ�룬���²����� | |
| C�� | ��ij��Һ�м���AgNO3��Һ�����ɰ�ɫ����������Һһ������Cl- | |
| D�� | ��Һʱ��������Ȼ�̼��Һ�ӷ�Һ©���¿ڷų���ˮ����Ͽڵ��� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com