
| 充电 |
| 放电 |

| ||
| ||


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
A、乙烯水化:CH2=CH2+H2O
| |||
B、葡萄糖发酵:C6H12O6
| |||
C、溴乙烷水解:CH3CH2Br+H2O
| |||
D、丙酸乙酯水解:CH3CH2COOCH2CH3+H2O
|
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 将一定体积的CO2通入到50mL某浓度的NaOH溶液中,得到溶液甲.为了测定其溶液甲的成分,向该溶液甲中加入1mol/L的盐酸,所加入的盐酸与产生CO2的体积(标况)的关系如图所示:
将一定体积的CO2通入到50mL某浓度的NaOH溶液中,得到溶液甲.为了测定其溶液甲的成分,向该溶液甲中加入1mol/L的盐酸,所加入的盐酸与产生CO2的体积(标况)的关系如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、绿色化学的核心是利用化学原理从源头上减少和消除工业生产对环境的污染 |
| B、“84”消毒液的有效成分为NaClO,能杀菌消毒 |
| C、某雨水放置一段时间后,pH由4.68变为4.28,是因为雨水在放置过程中溶解了较多的CO2 |
| D、高纯度的二氧化硅广泛用于制作光导纤维,光导纤维遇强碱会“断路” |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
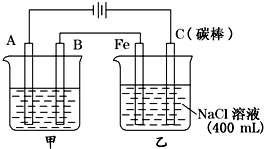 如图为相互串联的甲乙两电解池
如图为相互串联的甲乙两电解池| 物质 | Fe(OH)2 | Fe(OH)3 | Zn(OH)2 | Cu(OH)2 |
| KSP | 8.0×10-16 | 4.0×10-38 | 3.0×10-17 | 2.2×10-20 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 组别 | 药品1 | 药品2 | 实验现象 |
| Ⅰ | 0.01mol/L NaOH溶液 | 0.01mol/L MgCl2溶液 | 生成白色沉淀 |
| Ⅱ | 0.01mol/L氨水 | 0.01mol/L MgCl2溶液 | 无现象 |
| Ⅲ | 0.1mol/L氨水 | 0.1mol/L MgCl2溶液 | |
| IV | 0.1mol/L氨水 | 0.01mol/L MgCl2溶液 | 生成白色沉淀 |
| V | 0.01mol/L氨水 | 0.1mol/L MgCl2溶液 | 无现象 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com