
分析 发生3Cu+8HNO3 =3Cu(NO3)2+4H2O+2NO↑,
(1)根据方程式计算生成一氧化氮物质的量根据V=n×Vm计算;
(2)根据方程式计算消耗的硝酸,用原由硝酸减去消耗的即为剩余的硝酸;
(3)根据消耗的硝酸根转变为一氧化氮气体解答;
(4)根据氢离子和Cu2+都消耗氢氧根离子,求出氢氧化钠溶液的体积.
解答 解:(1)n(Cu)=$\frac{1.92g}{64g/mol}$=0.03mol,n(HNO3)=V•c=0.5L×0.2 mol•L-1=0.1 mol,
由3Cu+8HNO3 =3Cu(NO3)2+4H2O+2NO↑可知,稀硝酸过量,
设生成的一氧化氮物质的量为x,则
3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O
3 2
0.03mol x
生成NO的物质的量x=$\frac{2×0.03mol}{3}$=0.02mol,标准状况下所占的体积为V=n×Vm=0.02mol×22.4L/mol=0.448L,
故答案为:0.448L;
(2)设消耗硝酸的物质的量y
3Cu+8HNO3 =3Cu(NO3)2 +2NO↑+4H2O
3 8
0.03mol y
消耗硝酸的物质的量y=$\frac{0003mol×8}{3}$=0.08mol,则反应后溶液中H+的物质的量浓度是C=$\frac{n}{V}$=$\frac{0.1mol-0.08mol}{0.5L}$=0.04mol/L,
故答案为:0.04mol/L;
(3)500mL0.2mol•L-1的稀硝酸中n(NO3-)=0.1mol,由3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O可知,生成0.02molNO时消耗0.02mol硝酸根离子,反应后溶液中NO3-的物质的量为0.1mol-0.02mol=0.08mol,反应后溶液中NO3-的物质的量浓度是c=$\frac{n}{V}$=$\frac{0.08mol}{0.5L}$=0.16mol/L,
故答案为:0.16mol/L;
(4)因剩余的氢离子需要0.02mol氢氧根离子中和,每1mol铜离子需要2mol氢氧根离子转化成氢氧化铜沉淀,这需要0.06mol氢氧根,所以一共需要的氢氧根离子0.02+0.06=0.08mol,也就是0.08mol氢氧化钠氢氧化钠体积为V=$\frac{n}{c}$=$\frac{0.02mol}{0.2mol/L}$=0.4L=400mL,
故答案为:400.
点评 本题考查化学反应方程式的计算,为高频考点,把握发生的反应及物质的量的关系为解答的关键,侧重分析与计算能力的考查,注意硝酸的性质、化学计算中的过量判断以及守恒法的运用,题目难度中等.


 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 0.01% | B. | 0.1% | C. | 0.2% | D. | 1% |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
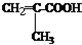 .
.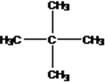 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
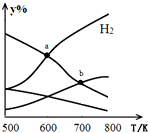 以二氧化碳和氢气为原料制取乙醇的反应为:2CO2(g)+6H2(g)$\stackrel{催化剂}{?}$CH3CH2OH(g)+3H2O(g)△H<0某压强下的密闭容器中,按CO2和H2的物质的量比为1:3投料,不同温度下平衡体系中各物质的物质的量百分数(y%)随温度变化如图所示.下列说法正确的是( )
以二氧化碳和氢气为原料制取乙醇的反应为:2CO2(g)+6H2(g)$\stackrel{催化剂}{?}$CH3CH2OH(g)+3H2O(g)△H<0某压强下的密闭容器中,按CO2和H2的物质的量比为1:3投料,不同温度下平衡体系中各物质的物质的量百分数(y%)随温度变化如图所示.下列说法正确的是( )| A. | a点的平衡常数小于b点 | |
| B. | b点,v正(CO2)=v逆(H2O) | |
| C. | a点,H2和H2O物质的量相等 | |
| D. | 其他条件恒定,充入更多H2,v(CO2)不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 还原性:HI>HBr>HCl>HF | |
| B. | 晶体熔点:金刚石>SiC>NaCl>Na>Mg>Al | |
| C. | 酸性:HClO4>H2SO4>H2SO3>HClO | |
| D. | 晶格能:MgF2>NaCl>NaBr |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 编号 | ① | ② | ③ | ④ |
| 装置 | 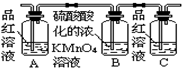 |  |  |  |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属A在常温下能与浓硝酸反应,而B不能 | |
| B. | 金属A的阳离子的氧化性比金属B的阳离子的氧化性弱 | |
| C. | 工业上制取金属A只能用电解的方法,而金属B一般都用还原剂将其还原 | |
| D. | 将金属A和金属B用导线相连后插入某电解质溶液中构成原电池,金属A作负极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳氢原子个数比为1:3的烃有两种 | |
| B. | 碳碳间以单键结合,碳原子剩余价键全部与氢原子结合的烃一定是饱和链烃 | |
| C. | 丙烷分子中的3个碳原子一定在同一平面上,丁烷分子中的4个碳原子不一定 | |
| D. | 常温下,液态烷中仅有一种一氯代物的只有新戊烷 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com