
下列实验现象可用同一原理解释的是
A. 品红溶液中分别通入SO2和Cl2,品红均褪色
B. 溴水分别滴入植物油和裂化汽油中,溴水均褪色
C. 鸡蛋白溶液中分别加入NaCl溶液和HgCl2溶液,均有固体析出
D. 分别加热盛有NH4Cl和单质碘的试管,管口均有固体凝结
科目:高中化学 来源:2017届河北省高三下学期周练(2)化学试卷(解析版) 题型:选择题
下列家庭化学小实验不能达到预期目的的是
A. 用米汤检验食用加碘盐(含KIO3)中含有碘
B. 用醋、石灰水验证蛋壳中含有碳酸盐
C. 用碘酒检验汽油中是否含有不饱和烃
D. 用鸡蛋白、食盐、水完成蛋白质的溶解、盐析实验?
查看答案和解析>>
科目:高中化学 来源:2017届吉林省长春市高三下学期第二次质量监测理综化学试卷(解析版) 题型:简答题
工业上常以铬铁矿(主要成分为亚铬酸亚铁FeCr2O4,还含有Al2O3、SiO2等杂质)为主要原料生产红矾钠(Na2Cr2O7),某实验小组模拟其流程如下图所示:
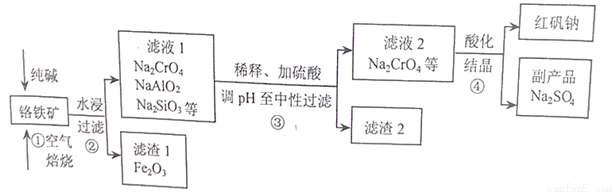
(1)FeCr2O4中Cr的化合价为____________,步骤①焙烧时所用的仪器名称为_________;步骤①中生成Na2CrO4的化学方程式为________________________。
(2)步骤①煅烧反应极慢,需要升温至纯碱呈熔融状态,反应速率才加快,其主要原因为________。
(3)步骤②过滤时所用到的玻璃仪器有________________;
(4)涉骤③用硫酸将溶液的pH调至中性,所得滤渣2的主要成分是__________、__________;
(5)步骤④向滤液2加入硫酸酸化过程中,溶液由黄色变为橙色,反应的离子方程式为___________。
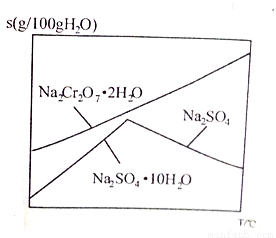
(6)下图是Na2Cr2O7·2H2O和Na2SO4的溶解度曲线,步骤④中获得副产品Na2SO4的实验操作方法为____________________。
查看答案和解析>>
科目:高中化学 来源:2017届湖南省、衡阳八中等十三校重点中学高三第一次联考化学试卷(解析版) 题型:选择题
下列溶液中微粒的物质的量浓度关系正确的是
A. 室温下,向0.01mol/LNH4HSO4溶液中滴加Na0H溶液至中性:c(Na+)>c(SO42-)>c(NH4+)> c(OH-)= c(H+)
B. Na2CO3溶液:c(Na+)+ c(H+)=c(HCO3-)+c(CO32-)+ c(OH-)
C. 等浓度的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO-)= c(HCO3-)+c(H2CO3)
D. 氯水中:2c(Cl2)=c(ClO-)+c(Cl-)+c(HClO)
查看答案和解析>>
科目:高中化学 来源:2017届湖南省、衡阳八中等十三校重点中学高三第一次联考化学试卷(解析版) 题型:选择题
卤族元素包括F、Cl、Br等,下列曲线表示卤族元素某种性质随核电荷数的变化趋势正确的是
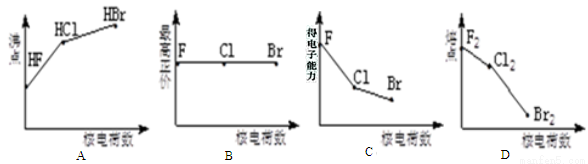
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源:2017届湖南省、衡阳八中等十三校重点中学高三第一次联考化学试卷(解析版) 题型:选择题
中国古代化学成绩斐然,下列说法错误的是
A. 古代造纸是以木材等为原料,用去除杂质后的纤维素制成的,纤维素属子天然高分子
B. 火药是由硫磺、木炭、硝酸钾按照一定比例混合制得的
C. “China”来源于闻名于世的我国陶瓷,陶瓷是一种硅酸盐产品
D. 司母戊鼎是商朝铸造的青铜器,它是由纯铜制作的
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省高二3月学业水平测试化学试卷(解析版) 题型:选择题
下列离子方程式正确的是( )
A. 稀硫酸与氢氧化钡溶液反应:H++OH一=H2O
B. 金属钠与水反应:Na+ H2O=Na++OH一+ H2↑
C. 铝与氢氧化钠溶液反应: 2Al+2OH一+2H2O=2A1O2一+3H2↑
D. 硅酸钠与稀硫酸反应:Na2SiO3+2H+===2Na++H2SiO3↓
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省高二3月学业水平测试化学试卷(解析版) 题型:选择题
下列过程中没有发生化学变化的是( )
A. 煤的液化 B. 从海水中得到金属钠
C. 石油蒸馏得汽油 D. 从海带中提取碘
查看答案和解析>>
科目:高中化学 来源:2017届湖北省黄冈市高三3月质量检测理科综合化学试卷(解析版) 题型:简答题
NH3作为一种重要化工原料,被大量应用于工业生产,与其有关性质反应的催化剂研究曾被列入国家863计划。
(1)催化剂常具有较强的选择性,即专一性。已知:
反应I:4NH3(g) +5O2(g)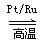 4NO(g) +6H2O(g) △H= -905.0 kJ·mol-1
4NO(g) +6H2O(g) △H= -905.0 kJ·mol-1
反应II:4NH3(g)+3O2(g) 2N2(g) +6H2O(g) △H= -1266.6 kJ·mol-1
2N2(g) +6H2O(g) △H= -1266.6 kJ·mol-1
写出NO分解生成N2与O2的热化学方程式_____。
(2)在恒温恒容装置中充入一定量的NH3和O2,在某催化剂的作用下进行反应I ,测得不同时间的NH3和O2,的浓度如下表:
时间(min) | 0 | 5 | 10 | 15 | 20 | 25 |
c(NH3)/mol·L-1 | 1.00 | 0.36 | 0.12 | 0.08 | 0.072 | 0.072 |
c(O2)/mol• L-1 | 2.00 | 1.20 | 0.90 | 0.85 | 0.84 | 0.84 |
则下列有关叙述中正确的是_____________。
A.使用催化剂时,可降低该反应的活化能,加快其反应速率
B.若测得容器内4v正(NH3) =6v逆(H2O)时,说明反应已达平衡
C.当容器内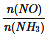 =1时,说明反应已达平衡
=1时,说明反应已达平衡
D.前10分钟内的平均速率v( NO)=0.088 mol·L-1·min-1
(3)氨催化氧化时会发生上述两个竞争反应I、II。为分析某催化剂对该反应的选择性,在1L密闭容器中充入1 mol NH3和2mol O2,测得有关物质的量关系如下图:
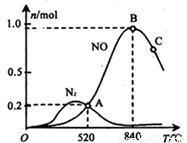
①该催化剂在低温时选择反应_______(填“ I ”或“ II”)。
②52℃时,4NH3+3O2 2N2+6H2O的平衡常数K=_______(不要求得出计算结果,只需列出数字计算式)。
2N2+6H2O的平衡常数K=_______(不要求得出计算结果,只需列出数字计算式)。
③C点比B点所产生的NO的物质的量少的主要原因________。
(4)制备催化剂时常产生一定的废液,工业上常利用氢硫酸检测和除去废液中的Cu2+。
已知:25℃时,K1(H2S) =1.3×10-7,K1(H2S) =7.1×10-15,Ksp(CuS) =8.5×10-45
①在计算溶液中的离子浓度时,涉及弱酸的电离通常要进行近似处理。则0.lmol •L-1氢硫酸的pH≈______(取近似整数)。
②某同学通过近似计算发现0.lmol •L-1氢硫酸与0.0lmol •L-1氢硫酸中的c(S2-)相等,而且等于_____mol·L-1
③已知,某废液接近于中性,若加入适量的氢硫酸,当废液中c(Cu2+) >_____ mol·L-1(计算结果保留两位有效数字),就会产生CuS沉淀。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com