
有X、Y、Z、W、M五种短周期元素,其中X、Y、Z、W同周期,Z、M同主族;X+与M2-具有相同的电子层结构;Z2-离子半径大于W-离子半径;Y是一种重要的半导体材料。下列说法中错误的是
A.元素X、M可形成既含离子键又含共价键的化合物
B.气态氢化物的稳定性:Z<W
C.Y元素在自然界中以化合物的形式存在
D.W元素的含氧酸都属于强酸
科目:高中化学 来源:2015届北京市高三8月开学测试化学试卷(解析版) 题型:选择题
交警对驾驶员是否饮酒进行检测的原理是橙色的酸性K2Cr2O7水溶液遇呼出的乙醇蒸气迅速变蓝,生成蓝绿色的Cr3+。下列对乙醇的描述与此测定原理有关的是
①乙醇沸点低 ②乙醇密度比水小 ③乙醇具有还原性
④乙醇是烃的含氧衍生物 ⑤乙醇可与羧酸在浓硫酸的作用下发生取代反应
A.②⑤ B.②③ C.①③ D.①④
查看答案和解析>>
科目:高中化学 来源:2015届云南省高三上学期第一次月考化学试卷(解析版) 题型:选择题
足量铜与一定量浓硝酸反应,得到硝酸铜溶液和NO2、N2O4、NO的混合气体,这些气体与1.68 L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入5mol· L-1 NaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是( )
A.60 mL B.45 mL C.30 mL D.15 mL
查看答案和解析>>
科目:高中化学 来源:2015届云南省高三上学期第一次月考化学试卷(解析版) 题型:选择题
能正确表示下列反应的离子方程式的是( )
A.足量的硫酸铝溶液与纯碱溶液反应: 2A13++3CO32-+3H2O =2A1(OH)3↓+3CO2↑
B. NaHS溶液的水解方程式: HS-+H2O H3O++S2-
H3O++S2-
C. Fe(OH)3与足量的HI溶液反应: Fe(OH)3+3H+=Fe3++3H2O
D.向亚硫酸氢铵溶液中加入足量的NaOH溶液: NH4++OH-=NH3·H2O
查看答案和解析>>
科目:高中化学 来源:2015届云南省云龙县高二下学期期末考试化学试卷(解析版) 题型:实验题
(14分)I.草酸晶体的组成可用H2C2O4·x H2O表示,为了测定x值,进行如下实验:
(1) 称取Wg草酸晶体,配成100.00 mL水溶液
(2) 取25.00mL所配制的草酸溶液置于锥形瓶内,加入适量稀H2SO4后,用浓度为a mol·L—1的KMnO4溶液滴定至KMnO4不再褪色为止,所发生的反应为:
2 KMnO4 + 5 H2C2O4 + 3 H2SO4 = K2SO4 + 10CO2↑ + 2MnSO4 + 8H2O
试回答:
①在滴定过程中若用去a mol·L—1的KMnO4溶液V mL,则所配制的草酸溶液的物质的量浓度为 mol·L—1,由此可计算x的值是 。
②若滴定终点读数时俯视,则计算的x值可能会 (偏大、偏小、无影响)。
Ⅱ.实验室用少量的溴和足量的乙醇制备1,2—二溴乙烷的装置如下图所示:
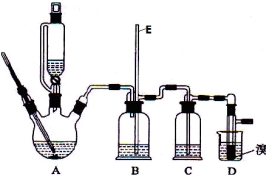
提示:乙醇与浓硫酸在140℃时脱水生成乙醚,在170℃时脱水生成乙烯。
有关数据列表如下:
| 乙醇 | 1,2-二溴乙烷 | 乙醚 |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/g · cm-3 | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | -130 | 9 | -116 |
回答下列问题:
(1)装置D中发生主要反应的化学方程式为 。
(2)装置B的作用 ,长玻璃管E的作用 。
(3)在装置C中应加入 ,其目的是吸收反应中可能生成的酸性气体 (填正确选项前的字母)。
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(4) 反应过程中应用冷水冷却装置D,其主要目的是 ;但又不能过度冷却(如用冰水),其原因是 ;将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在 层(填“上”、“下”)。
(5)若产物中有少量未反应的Br2,最好用 洗涤除去 (填正确选项前的字母) 。
a.水 b.氢氧化钠溶液 c.碘化钠溶液 d.乙醇
查看答案和解析>>
科目:高中化学 来源:2015届云南省云龙县高二下学期期末考试化学试卷(解析版) 题型:选择题
A是一种常见单质,B、C为常见化合物,A、B、C均含有元素X,它们有如下图的转化关系(部分产物及反应条件已略去)。下列判断正确的是
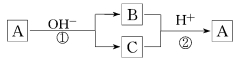
A.X元素可能为Al
B.X元素一定为金属元素
C.反应①和②一定互为可逆反应
D.反应①和②一定为氧化还原反应
查看答案和解析>>
科目:高中化学 来源:2015安徽望江中学同步(人教选修4)1.1.1化学反应与能量的变化(解析版) 题型:填空题
下表中的数据是破坏1 mol物质中的化学键所消耗的能量(kJ):
物质 | Cl2 | Br2 | I2 | HCl | HBr | HI | H2 |
能量/kJ | 243 | 193 | 151 | 432 | 366 | 298 | 436 |
根据上述数据回答(1)~(5)题。
(1)下列物质本身具有的能量最低的是 。
A.H2B.Cl2 C.Br2D.I2
(2)下列氢化物中,最稳定的是 。
A.HCl B.HBr C.HI
(3)X2+H2 2HX(X代表Cl、Br、I )的反应是吸热反应还是放热反应?答: 。
2HX(X代表Cl、Br、I )的反应是吸热反应还是放热反应?答: 。
(4)相同条件下,X2(X代表Cl、Br、I)分别与氢气反应,当消耗等物质的量的氢气时,放出或吸收的热量最多的是 。
(5)若无上表中的数据,你能正确回答出问题(4)吗?
答: ,你的根据是 。
查看答案和解析>>
科目:高中化学 来源:2015安徽望江中学同步课时(人教选修4)2.2影响化学反应速率的因素(解析版) 题型:填空题
某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)上述实验中发生反应的化学方程式有 ;
(2)要加快上述实验中气体产生的速率,还可采取的措施有 (答两种);
(3)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应容器中,收集产生的气体,记录获得相同体积的气体所需时间。
实验 混合溶液 | A | B | C | D | E | F |
4 mol·L-1 H2SO4溶液/mL | 30 | V1 | V2 | V3 | V4 | V5 |
饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
①请完成此实验设计,其中:V1= ,V6= ,V9= ;
②反应一段时间后,实验A中的金属呈 色,实验E中的金属呈 色;
③该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高。但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因 。
查看答案和解析>>
科目:高中化学 来源:2015安徽望江中学同步课时练(人教选修4)第三章检测试卷(解析版) 题型:选择题
温度相同,浓度均为0.2 mol·L-1的①(NH4)2SO4,②NaNO3,③NH4HSO4,④NH4NO3,⑤CH3COONa溶液,它们的pH由小到大的排列顺序是( )
A.③①④②⑤
B.①③⑤④②
C.③②①⑤④
D.⑤②④①③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com