
下列关于弱电解质的电离平衡常数的叙述中,正确的是( )
A.因为电离是吸热的,所以温度越高,同一弱电解质的电离平衡常数越小
B.弱电解质的电 离平衡常数只与弱电解质的本性及外界温度有关
离平衡常数只与弱电解质的本性及外界温度有关
C.同一温度下,弱酸的电离平衡常数越大,酸性越强;弱碱的电离平衡常数越大,碱性越弱
D.多元弱酸的各级电离常数相同
 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案科目:高中化学 来源: 题型:
下列过程没有发生化学反应的是( )
A.用活性炭去除冰箱中的异味
B.用热碱水清除炊具上残留的油污
C.用浸泡过高锰酸钾溶液的硅藻土保鲜水果
D.用含硅胶、铁粉的透气小袋与食品一起密封包装
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述中,不正确的是 ( )
A.CaCO3属于碳酸盐
B.盐酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物
C.蓝矾(CuSO4·5H2O)和干冰属于化合物,铁矿石属于混合物
D.通过化学反应,可由Ba(OH)2一步转化生成NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
金属离子和硫离子在水溶液中的反应比较复杂,其产物与离子的水解、金属硫化物的溶解度、离子的氧化性或还原性等因素有关。经过查阅资料可知,CuS在水中的溶解度很小,在稀酸溶液中也不溶解;Fe2S3在水中的溶解度更小,但却能溶于稀酸。下列有关说法正确的是( )
A.Cu2+和S2-在水溶液中反应的产物是CuS
B.NH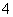 和S2-在水溶液中发生相互促进的水解反应,所以不存在(NH4)2S的水溶液
和S2-在水溶液中发生相互促进的水解反应,所以不存在(NH4)2S的水溶液
C.Fe3+和S2-在酸性溶液中反应的产物只可能是Fe2+、S
D.Fe3+的氧化性比Cu2+的弱
查看答案和解析>>
科目:高中化学 来源: 题型:
菱锰矿的主要成分是MnCO3(含有少量FeS2、Al2O3),以菱锰矿为原料制备锰单质的流程如下所示:

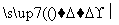 浆化
浆化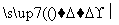 溶液1
溶液1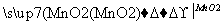 溶液2
溶液2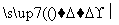 精制—→电解—→Mn
精制—→电解—→Mn
请回答下列问题:
(1)菱锰矿在浸取前需要粉碎,其目的是______________________________。
(2)用稀硫酸浸取时,主要反应的离子方程式为____________;加入二氧化锰时被氧化的物质是____________(填化学式)。
(3)已知Fe、Al、Mn的氢氧化物开始沉淀及沉淀完全时的pH如表所示,则加氨水沉淀时应控制溶液的pH范围为______________。此时得到的沉淀是____________、__________(填化学式)。
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀pH | 1.8 | 4.1 | 8.3 |
| 完全沉淀pH | 3.2 | 5.0 | 9.8 |
(4)电解硫酸锰溶液时,阴极的电极反应式为____________________。用酸性高锰酸钾溶液检验Mn2+,产生黑色沉淀,该反应的离子方程式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
室温时冰醋酸加水稀释过程中导电能力的变化如图所示。溶液的导电性体现了溶液中离子浓度大小。一般来说,溶液导电能力越强,离子浓度越大。
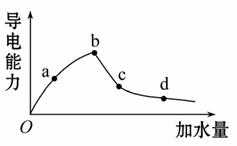
(1)图中O点[H+]=________mol·L-1。
(2)a、b、c、d四点中溶液的[H+]大小顺序为____________。电离程度大小顺序为______。电离平衡常数大小顺序为__________。(用“>”“=”或“<”来表示)
(3)若要使c点溶液中[CH3COO-]增大,而又不产生气体,则下列措施中可选择
_______ _。
_。
A.加水 B.加热
C.加锌粒 D.加固体NaOH
E.加很稀的 NaOH溶液 F.加固体CH3COON
NaOH溶液 F.加固体CH3COON a
a
(4)设d点醋酸溶液的浓度为c mol·L-1,此温度下醋酸的电离常数为Ka mol·L-1,达到平衡时醋酸分子浓度可近似为c mol·L-1,求平衡时溶液的pH(用Ka和c表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
某温度下纯水的pH=6。
(1)pH=7的溶液呈__________(填“酸性”“中性”或“碱性”);
(2)该温度下0.1 mol·L-1的盐酸溶液的pH=__________;
(3)0.05 mol·L-1的Ba(OH)2溶液的pH=__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
C、H2、CH4都是优质的能源物质,目前对这三种物质的研究是燃料研究的重点,下列关于这三种物质的研究方向中可行的是( )
A.寻找优质催化剂,使CO2与H2O反应生成CH4与O2,并放出热量
B.寻找优质催化剂,在常温常压下使CO2分解生成碳与O2
C.寻找优质催化剂,利用太阳能使大气中的CO2与海底开采的CH4合成合成气(CO、H2)
D.将固态碳合成为C60,以C60作为燃料
查看答案和解析>>
科目:高中化学 来源: 题型:
某同学参阅了“84消毒液”说明中的配方,欲用NaClO固体配制480 mL含 NaClO 25%,密度为1.19 g/cm3的消毒液。下列说法正确的是 ( )
A.定容摇匀后,有少量溶液外流,则NaClO的物质的量浓度偏小
B.容量瓶用蒸馏水洗净后必须烘干才能用于溶液的配制
C.所配得的NaClO消毒液在空气中光照,久置后溶液中NaClO的物质的量浓度减小
D.需要称量的NaClO固体的质量为142.8 g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com