
【题目】无水MgBr2可广泛用于有机反应催化剂、污水处理剂等。实验室可用镁屑与液溴为原料,采用下图装置制备无水MgBr2,请回答:
(1)识别下图中仪器。A的名称是_____,B是_____

(2)实验时,可向装置 C 中缓慢通入干燥的氮气,直至溴完全导入 三颈瓶中。干燥的氮气能将液溴吹出,因为液溴具有_____的性质;实验中不能用干燥空气代替干燥N2,原因是:____MgBr2和乙醚能发生如下反应:MgBr2+3C2H5OC2H5![]() MgBr2·3C2H5OC2H5+Q(Q>0);反应完毕后恢复至室温,过滤,滤液转移至另一干燥的烧瓶中,冷却至0℃,析出晶体,再过滤得三乙醚合溴化镁粗品。第一次过滤除去的 物质是____。过滤必须用到的玻璃仪器是:____。
MgBr2·3C2H5OC2H5+Q(Q>0);反应完毕后恢复至室温,过滤,滤液转移至另一干燥的烧瓶中,冷却至0℃,析出晶体,再过滤得三乙醚合溴化镁粗品。第一次过滤除去的 物质是____。过滤必须用到的玻璃仪器是:____。
(3)试用平衡移动的原理说明得到三乙醚合溴化镁后,加热有利于其分解,得无水MgBr2产品的原因:____。
(4)为测定产品的纯度,可用EDTA(简写为Y4-)标准溶液滴定,反应的离子方程式:Mg2++Y4-=MgY2-
①滴定前润洗滴定管的操作方法是____。
②测定前,先称取0.2500g无水MgBr2产品,溶解后,用0.0500mol/L的EDTA标准溶液滴定至终点,消耗EDTA标准溶液26.50mL,则测得无水MgBr2产品的纯度是____(以质量分数表示)。
【答案】 干燥管 冷凝管 极易挥发 防止镁屑与氧气反应,生成副产物 MgO,且阻碍 Mg 和 Br2 的反应 镁屑 漏斗、烧杯、玻璃棒 加热促使乙醚挥发,且逆反应是吸热反应,加热后平衡朝有利于三乙醚合溴化镁分解的方向移动 从滴定管上口加入少标准液,倾斜着转动滴定管,使液体润湿内壁,然后从下部放 出,重复 2-3 次 97.5%
【解析】(1)根据图中仪器可知,A 的名称是干燥管,B 是冷凝管;(2)干燥的氮气能将液溴吹出,因为液溴极易挥发;实验中不能用干燥空气代替干燥N2,MgBr2和乙醚能发生如下反应:MgBr2+3C2H5OC2H5![]() MgBr2·3C2H5OC2H5+Q(Q>0)原因是:防止镁屑与氧气反应,生成副产物 MgO,且阻碍 Mg和Br2的反应;反应完毕后恢复至室温,过滤,滤液转移至另一干燥的烧瓶中,冷却至0℃,析出晶体,再过滤得三乙醚合溴化镁粗品。第一次过滤除去的 物质是镁屑。过滤必须用到的玻璃仪器是:漏斗、烧杯、玻璃棒;(3)加热促使乙醚挥发,且逆反应是吸热反应,加热后平衡朝有利于三乙醚合溴化镁分解的方向移动,从而得无水MgBr2;(4)①滴定前润洗滴定管的操作方法是从滴定管上口加入少标准液,倾斜着转动滴定管,使液体润湿内壁,然后从下部放 出,重复 2-3 次;②根据反应Mg2++ Y4-=MgY2-可知,测定前,先称取 0.2500g 无水 MgBr2 产品,溶解后,用 0.0500 mol/L 的 EDTA 标准溶液滴定至终点,消耗 EDTA
MgBr2·3C2H5OC2H5+Q(Q>0)原因是:防止镁屑与氧气反应,生成副产物 MgO,且阻碍 Mg和Br2的反应;反应完毕后恢复至室温,过滤,滤液转移至另一干燥的烧瓶中,冷却至0℃,析出晶体,再过滤得三乙醚合溴化镁粗品。第一次过滤除去的 物质是镁屑。过滤必须用到的玻璃仪器是:漏斗、烧杯、玻璃棒;(3)加热促使乙醚挥发,且逆反应是吸热反应,加热后平衡朝有利于三乙醚合溴化镁分解的方向移动,从而得无水MgBr2;(4)①滴定前润洗滴定管的操作方法是从滴定管上口加入少标准液,倾斜着转动滴定管,使液体润湿内壁,然后从下部放 出,重复 2-3 次;②根据反应Mg2++ Y4-=MgY2-可知,测定前,先称取 0.2500g 无水 MgBr2 产品,溶解后,用 0.0500 mol/L 的 EDTA 标准溶液滴定至终点,消耗 EDTA
标准溶液 26.50 mL,则测得无水 MgBr2 产品的纯度是![]() 。
。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列有关化学实验不能达到目的是( )
A.采用如图所示的装置制取少量的氢氧化亚铁 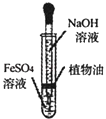
B.加热苯、液溴和浓硫酸的混合物制取少量的溴苯
C.用碎瓷片作催化剂进行石蜡油的受热分解实验
D.用滴有少量硫酸铜溶液的稀硫酸跟锌粒反应快速地制氢气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1-丁醇和乙酸在浓硫酸作用下,通过酯化反应制得乙酸丁酯,反应温度为115~125℃,反应装置如图。下列对该实验的描述错误的是
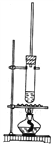
A. 不能用水浴加热
B. 长玻璃管起冷凝回流作用
C. 为提纯乙酸丁酯,可用水和碳酸钠溶液洗涤
D. 通常加入过量1-丁醇以提高乙酸的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在 Cu/ZnO催化剂存在下,CO2和H2可发生下列反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
(1)反应中被氧化的元素是:____,氧化剂是____。试在下列方程式中用单线桥标出电子转移的方向和数目:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)____
CH3OH(g)+H2O(g)____
(2)该反应的平衡常数表达式 K=____。若只增加CO2的浓度,该平衡向____移动,平衡常数 K___(选填“增大”、“小”或“不变”)。
(3)从下图可以看出,由于温度不同,A和B中___先达到平衡状态,说明反应温度 A___B(选填“>”、“<”或“=”),从甲醇体积分数的比较还可以说明该反应是______热反应(选填“放”或“吸”);反应进行到图中M处时,正反应速率______逆反应速率(选填“>”、 “<”或“=”)。

(4)一定条件下,将 n(CO2):n(H2)=1:1 的混合气充入恒温恒容密闭容器中,若容器中气体______(选填“密度”或“压强”)保持不变,说明该反应已达平衡状态。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法中正确的是
A. 28g乙烯所含的共用电子对数目为2NA
B. 133.5AlCl3晶体含有的粒子数目为4NA
C. 0.1molCl2与足量石灰乳反应,转移电子的数目为0.2NA
D. 4.6gNO2和N2O4组成的混合气体含有的氧原子数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温:Ksp(PbI2)=4×10-6,Ksp(PbS)=8×10-28。取适量黄色PbI2固体配制成100mL溶液,配制过程中溶液的离子浓度与时间的变化关系如图所示。下列说法中正确的是

A. A点处可表示PbI2的不饱和溶液
B. T时刻有可能向该PbI2溶液中加人了KI固体
C. 常温下PbI2饱和溶液中的c(I-)=10-2mol/L
D. 向A点处的PbI2溶液中加入100mL 2×10-3mol/L的Na2S溶液,平衡后溶液中的c(Pb2+)<4×10-3mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D是原子序数依次递增的前四周期元素,A元素的正化合价与负化合价的代数和为零;B元素原子的价电子结构为nsnnpn;C元素基态原子s能级的电子总数比p能级的电子总数多1;D元素原子的M能层全满,最外层只有一个电子。请回答:
(1)A元素的单质为A2,不能形成A3或A4,这体现了共价键的___性;B元素单质的一种空间网状结构的晶体熔点>3550℃,该单质的晶体类型属于________;基态D原子共有___种不同运动状态的电子。
(2)A与C形成的最简单分子的中心原子杂化方式是___________,该分子与D2+、H2O以2:1:2的配比结合形成的配离子是_________(填化学式),此配离子中的两种配体的不同之处为_____(填标号)。
①中心原子的价层电子对数 ②中心原子的孤电子对的对数 ③中心原子的化学键类型 ④VSEPR模型
(3)1molBC—中含有的π键数目为______;写出与BC-互为等电子体的分子和离子各一种______、______。
(4)D2+的硫酸盐晶体的熔点比D2+的硝酸盐晶体的熔点高,其原因是______。
(5)D3C具有良好的电学和光学性能,其晶体的晶胞结构如图所示,D+和C3—半径分别为apm、bpm,D+和C3—都是紧密接触的刚性小球,则C3—的配位数为_____,晶体的密度为____g·cm-3。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示为石蜡油分解的实验装置。在试管①中加入石蜡油和氧化铝;试管②放在冷水中;试管③中加入酸性高锰酸钾溶液;试管④中加入溴水。分析实验完成下列各题:

分析实验回答下列问题:
(1)试管①中加入氧化铝的作用是____________________________________________。
(2)试管②内看到的实验现象是______________________________________________。
(3)试管③中看到的实验现象为_______________________________________________,发生________反应(填反应类型)。
(4)试管④中看到的实验现象为_______________________________________________,发生________反应(填反应类型)。
(5)通过本实验说明______________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com