
| A. |  | B. |  | ||
| C. |  | D. |  |
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
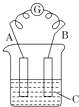 如图所示,电流表G发生偏转,同时A极逐渐变粗,B极逐渐变细,C为电解质溶液.
如图所示,电流表G发生偏转,同时A极逐渐变粗,B极逐渐变细,C为电解质溶液.查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加氢氧化钠溶液,加热,滴入酚酞试剂 | |
| B. | 加氢氧化钠溶液,加热,滴入紫色石蕊试剂 | |
| C. | 加氢氧化钠溶液,加热,将干燥的红色石蕊试纸靠近试管口 | |
| D. | 加氢氧化钠溶液,加热,将湿润的红色石蕊试纸靠近试管口 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
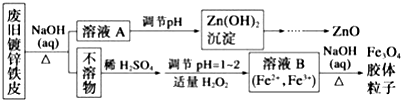
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有的化合反应不属于氧化还原反应 | |
| B. | 复分解反应部分属于氧化还原反应 | |
| C. | 置换反应一定是氧化还原反应 | |
| D. | CO与CuO反应不是置换反应,但属于氧化还原反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com