

分析 废渣(含Fe2+、Fe3+的硫酸盐及少量CaO和MgO),将废渣溶解,溶解时加入的物质能溶解废渣但不能引进杂质;然后向溶液中加入A,A具有氧化性,能氧化亚铁离子但不能引进新的杂质且原料易得、成本低,应为空气中的氧气,然后向溶液中加入氨水,溶液中硫酸铁和氨水反应生成铵黄铁矾,同时溶液中镁离子、钙离子形成氢氧化钙、氢氧化镁、硫酸钙等会结晶析出,采用过滤方法分离得到铵黄铁矾和滤液;将滤液蒸发浓缩回收硫酸铵;
将铵黄铁矾溶于水得到溶液,然后向溶液中加入氨水,得到氢氧化亚铁沉淀,然后过滤得到滤渣,将滤渣加热得到铁红,
(1)溶解废渣的溶剂能溶解废渣且不能引进新的杂质;
(2)提高废渣的浸取率可以粉粹、搅拌、升温等措施;
(3)A是氧化剂,具有氧化性,能氧化亚铁离子,但不能引进新的杂质且原料易得、成本低;亚铁离子在酸性溶液中被氧化为铁离子;
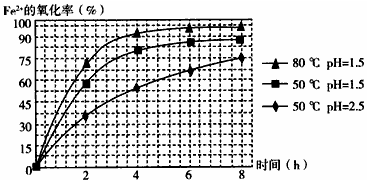
(4)依据图象分析,亚铁离子的氧化率最高是溶液温度为80℃,pH为1.5;
(5)向溶液中加入氨水,溶液中硫酸铁和氨水反应生成铵黄铁矾,同时溶液中镁离子、钙离子形成氢氧化钙、氢氧化镁、硫酸钙等会结晶析出;
(6)②9.32g为不溶于盐酸的硫酸钡沉淀;
③标准状况下气体448mL气体为氨气,红褐色沉淀为氢氧化铁;
④得到的固体是氧化铁;
根据以上分析数据及电荷守恒,计算出黄钾铵铁矾各种成分的物质的量之比,就是黄钾铵铁矾的化学式.
解答 解:(1)溶解废渣的溶剂能溶解废渣且不能引进新的杂质,氨水和NaOH不溶解CaO和MgO,稀盐酸能溶解废渣但引进杂质,稀硫酸能溶解废渣且不引进新的杂质,故选D,
故答案为:D;
(2)为了提高废渣的浸取率,可采用的措施有:将废渣粉碎、加热、搅拌等,
故答案为:将废渣粉碎、加热、搅拌等;
(3)A是氧化剂,具有氧化性,能氧化亚铁离子,但不能引进新的杂质且原料易得、成本低,氯气和二氧化锰都具有氧化性,但引进新的杂质且成本高,所以选取空气,氧化过程中发生反应的离子方程式为:4Fe2++O2+4H+═4Fe3++2H2O,
故答案为:空气;原料易得,成本低,不产生污染,不引入杂质;4Fe2++O2+4H+═4Fe3++2H2O;
(4)分析图象可知在80℃时 溶液PH=1.5,此时亚铁离子的氧化率在90%以上,时间在4h左右,
故答案为:溶液温度控制在80℃,pH控制在1.5,氧化时间为4 h左右;
(5)分析可知铵黄铁矾中可能混有的杂质有Fe(OH)3、Ca(OH)2、Mg(OH)2、CaSO4,
故答案为:Ca(OH)2、Mg(OH)2、CaSO4;
(6)②的沉淀为硫酸钡,硫酸钡的物质的量就等于溶液中硫酸根的物质的量:n(SO42-)=n(BaSO4)=$\frac{9.32g}{233g/mol}$=0.04 mol
③所得气体为氨气,溶液中铵离子物质的量就等于氨气的物质的量:n(NH4+)=n(NH3)=$\frac{0.448L}{22.4L/mol}$=0.02 mol
④最终得到的固体是氧化铁,根据铁原子守恒,溶液中的铁离子物质的量为:n(Fe3+)=2n(Fe2O3)=2×$\frac{4.80g}{160g/mol}$=0.06 mol
黄钾铵铁矾[(NH4)xFey(SO4)z(OH)w]中,n(NH4+)=0.02 mol,
根据电荷守恒:n(OH-)=n(NH4+)+3n(Fe3+)-2n(SO42-)=0.12 mol
n(NH4+):n(Fe3+):n(SO42-):n(OH-)=2:6:4:12
黄钾铵铁矾的化学式为(NH4)2Fe6(SO4)4(OH)12,
故答案为:(NH4)2Fe6(SO4)4(OH)12;
点评 本题考查了物质制备、提纯、分离方法的综合应用,题目难度中等,本题要注意从实验目的和分离除杂原则考虑,如滤渣溶解时加硫酸而不加盐酸,因目的是回收(NH4)2SO4,结合题设去看流程,不必对流程每一步都弄清楚,如:如何生成黄铁钒、如何生成硫酸铵等,试题有利于培养学生的分析、理解能力及化学实验能力.


科目:高中化学 来源: 题型:选择题
| A. | 离子化合物中可能含共价键 | B. | 离子化合物中一定含离子键 | ||
| C. | 离子化合物中不一定含金属元素 | D. | 离子化合物中一定含共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 时间/s | 0 | 500 | 1000 | 1500 |
| c(N2O5)/mol•L-1 | 5.00 | 2.25 | 2.50 | 2.50 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等体积等物质的量浓度的氢氧化钡溶液与碳酸氢铵溶液混合:Ba2++2OH-+NH4++HCO3-=BaCO3↓+NH3•H2O+H2O | |
| B. | 实验室配制的亚铁盐溶液在空气中被氧化:4Fe2++O2+2H2O=4Fe3++4OH- | |
| C. | 向碳酸氢铵溶液中加过量石灰水并加热:NH4++OH-$\frac{\underline{\;△\;}}{\;}$NH3↑+H2O | |
| D. | 用酸化的高锰酸钾溶液氧化双氧水:2MnO4-+6H++H2O2═2Mn2++3O2↑+4H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 E、F、D、X、Y、Z为前四周期元素,且原子序数依次增大.E的最高正价和最低负价的绝对值相等,F有三个能级,且每个能级上的电子数相等,D原子未成对电子数在同周期元素中最多,X与D同周期,第一电离能比D低,Y与F同主族,Z的最外层只有一个电子,其它电子层电子均处于饱和状态.请回答下列问题:
E、F、D、X、Y、Z为前四周期元素,且原子序数依次增大.E的最高正价和最低负价的绝对值相等,F有三个能级,且每个能级上的电子数相等,D原子未成对电子数在同周期元素中最多,X与D同周期,第一电离能比D低,Y与F同主族,Z的最外层只有一个电子,其它电子层电子均处于饱和状态.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 室温下,向200mL 0.1mol•L-1CH3COONa溶液中,逐渐加入0.1mol•L-1盐酸(不考虑挥发),CH3COOH、CH3COO-物质的量随加入盐酸体积的变化关系如图所示,下列说法正确的是( )
室温下,向200mL 0.1mol•L-1CH3COONa溶液中,逐渐加入0.1mol•L-1盐酸(不考虑挥发),CH3COOH、CH3COO-物质的量随加入盐酸体积的变化关系如图所示,下列说法正确的是( )| A. | 随着盐酸加入,溶液中水的电离程度逐渐增大 | |
| B. | 随着盐酸加入,$\frac{c(O{H}^{-})}{c(C{H}_{3}CO{O}^{-})}$逐渐增大 | |
| C. | M 点,n(H+)-n(OH-)=(a×10-4-0.01)mol | |
| D. | 当 V(盐酸)=200mL时,c(CH3COO-)+c(CH3COOH)>c(Cl-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:S<Cl | |
| B. | 元素非金属性:S>Cl | |
| C. | 氢化物的稳定性:H2S>HCl | |
| D. | 最高价氧化物对应水化物的酸性:H2SO4<HClO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通过树状分类法可把硝酸和硫酸分入强酸,把纯碱分入正盐 | |
| B. | 若按交叉分类法分类,碳酸钠既属于钠盐,又属于碳酸盐 | |
| C. | 先加入稀盐酸,没有产生沉淀,然后再加氯化钡,产生白色沉淀,证明有SO42-存在 | |
| D. | 先加入氯化钡,产生白色沉淀,然后再加稀盐酸,沉淀不溶解,证明有SO42-存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳氢化合物的通式为CnH2n+2 | |
| B. | 甲烷是一种比较洁净的能源 | |
| C. | 石油的主要成分是各种碳氢化合物组成的混合物 | |
| D. | 甲烷的二氯代物无同分异构体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com