
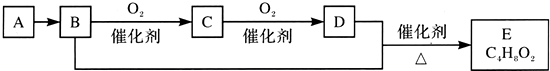
| A. | 鉴别A和甲烷可选择使用酸性高锰酸钾溶液 | |
| B. | D中含有的官能团为羧基,利用D物质可以清除水壶中的水垢 | |
| C. | 物质C的结构简式为CH3CHO,E的名称为乙酸乙酯 | |
| D. | B+D→E的化学方程式为CH3CH2OH+CH3COOH$?_{△}^{催化剂}$CH3COOC2H5 |
分析 化合物A只由碳、氢两种元素组成,能使溴水褪色,其产量用来衡量一个国家石油化工发展水平,则A是乙烯,B能被氧化生成C,C能被氧化生成D,B和D能反应生成E,则B是乙醇,C是乙醛,D是乙酸,乙醇和乙酸反应生成乙酸乙酯,即E为CH3COOC2H5.
解答 解:化合物A只由碳、氢两种元素组成,能使溴水褪色,其产量用来衡量一个国家石油化工发展水平,则A是乙烯,B能被氧化生成C,C能被氧化生成D,B和D能反应生成E,则B是乙醇,C是乙醛,D是乙酸,乙醇和乙酸反应生成乙酸乙酯,即E为CH3COOC2H5.
A.A为乙烯,含有碳碳双键,能使酸性高锰酸钾溶液褪色,甲烷不能,可用酸性高锰酸钾溶液鉴别二者,故A正确;
B.D为乙酸,醋酸的官能团为羧基,显酸性,可以与水垢的主要成分碳酸钙和氢氧化镁反应,故B正确;
C.物质C的结构简式为CH3CHO,E的名称为乙酸乙酯,故C正确;
D.酯化反应的产物还有水,反应方程式为:CH3CH2OH+CH3COOH$?_{△}^{催化剂}$CH3COOC2H5+H2O,故D错误.
故选:D.
点评 本题考查了有机物的推断,注意根据B能连续氧化,再结合B与D的产物推断,难度不大,D选项为易错点,学生容易忽略水.


科目:高中化学 来源: 题型:选择题
| A. | NH3•H2O的电离平衡常数随着温度升高而减小 | |
| B. | 在0.10 mol•L-1CH3COOH溶液中,加入少量CH3COONa晶体后,溶液的pH减小 | |
| C. | 强酸、强碱和大部分盐类都是强电解质,其他化合物都是弱电解质 | |
| D. | 相同温度下,醋酸溶液的导电能力可能比稀硫酸强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同温度下,CuS的溶解度大于ZnS的溶解度 | |
| B. | 将足量CuSO4溶解在0.1 mol•L-1的H2S溶液中,Cu2+能达到的最大浓度为1.3×10-35 mol•L-1 | |
| C. | 因为H2SO4是强酸,故CuSO4+H2S═CuS↓+H2SO4不能发生 | |
| D. | 除去工业废水中的Cu2+,可以选用FeS作沉淀剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O2、Na2O2都属于过氧化物,都存在非极性的共价键 | |
| B. | 双氧水是绿色氧化剂,可作医疗消毒剂 | |
| C. | H2O2既有氧化性,又有还原性,与Cl2、KMnO4反应是表现H2O2的氧化性 | |
| D. | H2O2做漂白剂是利用其氧化性,漂白原理与HClO类似,与SO2不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
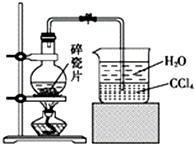 1-溴异戊烷[(CH3)2CHCH2CH2Br]是有机合成的重要中间体,可用于生产染料、催化剂等,其沸点为121℃,易溶于CCl4,可由异戊醇与氢溴酸在硫酸催化作用下反应而得:(CH3)2CHCH2CH2OH+HBr$\stackrel{△}{→}$(CH3)2CHCH2CH2Br+H2O.已知异戊醇的沸点为132.5℃,微溶于水,易溶于CCl4.实验室制备1-溴异戊烷的装置如图所示.
1-溴异戊烷[(CH3)2CHCH2CH2Br]是有机合成的重要中间体,可用于生产染料、催化剂等,其沸点为121℃,易溶于CCl4,可由异戊醇与氢溴酸在硫酸催化作用下反应而得:(CH3)2CHCH2CH2OH+HBr$\stackrel{△}{→}$(CH3)2CHCH2CH2Br+H2O.已知异戊醇的沸点为132.5℃,微溶于水,易溶于CCl4.实验室制备1-溴异戊烷的装置如图所示.| 反应物 | NaBr | 98.3% 浓H2SO4 | 异戊醇 | 水 |
| 用量 | 0.30mol | 35mL(过量) | 0.25mol | 30mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C4H10O的同分异构体有很多种,其中属于醇类的只有4种 | |
| B. | 水解得到的两种物质,C2H4O2可以与金属钠作用产生氢气,而C4H10O不可以 | |
| C. | 水解得到的物质C2H4O2和葡萄糖的最简式相同,所以二者的化学性质相似 | |
| D. | 该同学分离出的酯的化学式可表示为C6H12O2,它的同分异构体属于酯类的有10种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Zn和浓H2SO4 | B. | C和浓HNO3 | ||
| C. | Cu和浓HNO3 | D. | Na2O2和NH4Cl浓溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Z为0.3 | B. | Y2为0.4 | C. | X2为0.2 | D. | Z为0.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化合物 | MgO | Al2O3 | MgCl2 | AlCl3 |
| 类型 | 离子化合物 | 离子化合物 | 离子化合物 | 共价化合物 |
| 熔点/℃ | 2800 | 2050 | 714 | 191 |
 ;在上述由SiCl4制纯硅的反应中,测得每生成1.12kg纯硅需吸收akJ热量,写出该反应的热化学方程式2H2(g)+SiCl4(g)$\frac{\underline{\;1100℃\;}}{\;}$Si(s)+4HCl(g)△H=+0.025akJ•mol-1.
;在上述由SiCl4制纯硅的反应中,测得每生成1.12kg纯硅需吸收akJ热量,写出该反应的热化学方程式2H2(g)+SiCl4(g)$\frac{\underline{\;1100℃\;}}{\;}$Si(s)+4HCl(g)△H=+0.025akJ•mol-1.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com