
| c3(H+) |
| c(Cr3+) |
| c3(H+)×c3(OH-) |
| c(Cr3+)×c3(OH-) |
| (1×10-14)3 |
| 5×10-31 |


科目:高中化学 来源: 题型:
| (四) | (三) | (一) | (五) | (二) | (六) |
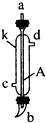 | 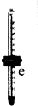 |  | 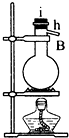 | 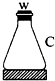 | 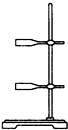 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用灼烧并闻气味的方法可区别真丝织物和纯羊毛织物 |
| B、用纯碱溶液可洗涤餐具上的油污 |
| C、水陆两用公共汽车中,用于密封的橡胶材料是高分子化合物 |
| D、新制Cu(OH)2悬浊液在医院中常用于尿糖的检测 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③⑤ | B、①②⑥ |
| C、②③⑤ | D、②④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、8.7g二氧化锰与50mL8mol?L-1浓盐酸共热制取氯气 |
| B、19.2g铜与100mL12mol?L-1的硝酸反应 |
| C、常温下,将5.4g铝片投入20mL18mol?L-1的硫酸中 |
| D、在5×107 Pa、500℃和铁触媒催化的条件下,用3 mol氢气和2 mol氮气合成氨 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、25℃,pH=12的烧碱溶液与纯碱溶液,水的电离程度相同 |
| B、其它条件不变,稀释醋酸钠溶液,水的电离程度增大 |
| C、其它条件不变,稀释氢氧化钠溶液,水的电离程度减小 |
| D、其它条件不变,温度升高,水的电离程度增大,Kw增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
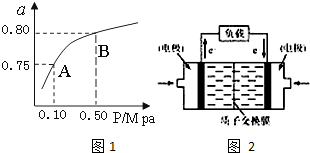 甲醇是重要的化学工业基础原料和液体燃料.工业上可利用CO或CO2来生产燃料甲醇.已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
甲醇是重要的化学工业基础原料和液体燃料.工业上可利用CO或CO2来生产燃料甲醇.已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:| 化学反应 | 平衡常数 | 温度(℃) | |
| 500 | 800 | ||
| ①2H2(g)+CO(g)?CH3OH(g) | K1 | 2.5 | 0.15 |
| ②H2(g)+CO2(g)?H2O (g)+CO(g) | K2 | 1.0 | 2.50 |
| ③3H2(g)+CO2(g)?CH3OH(g)+H2O (g) | K3 | ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com