
【题目】向盛有5 mL 0.01 mol/L的硫氰化钾溶液的小烧杯中,加入5 mL0.01 mol/L的FeCl3溶液,混合液立即__________。写出上述反应的离子方程式_____________。向以上溶液中再加0.1 mol/L NaOH溶液至过量,其现象是__________,写出发生上述现象的反应离子方程式_____________。
【答案】变红 3SCN-+Fe3+Fe(SCN)3 溶液红色褪去,并有红褐色沉淀生成 Fe(SCN)3+3OH-=Fe(OH)3↓+3SCN-
【解析】
Fe3+可以和SCN-发生络合反应生成Fe(SCN)3,该络合物呈红色,向含有该络合物的溶液中加入过量的NaOH溶液,OH-可以和络合物中的Fe3+发生反应生成沉淀。
根据分析,向KSCN溶液中加入FeCl3溶液,发生如下反应3SCN-+Fe3+![]() Fe(SCN)3,溶液立即变成血红色;再向含有Fe(SCN)3的溶液中加入NaOH,溶液颜色变浅至无色,同时生成红褐色沉淀,反应方程式为Fe(SCN)3+3OH-=Fe(OH)3↓+3SCN-。
Fe(SCN)3,溶液立即变成血红色;再向含有Fe(SCN)3的溶液中加入NaOH,溶液颜色变浅至无色,同时生成红褐色沉淀,反应方程式为Fe(SCN)3+3OH-=Fe(OH)3↓+3SCN-。


科目:高中化学 来源: 题型:
【题目】已知:4NH3+5O2![]() 4NO+6H2O,若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)[mol/(L·min)]表示,则正确的关系式是
4NO+6H2O,若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)[mol/(L·min)]表示,则正确的关系式是
A. 4v(NH3)=5v(O2) B. 5v(O2)=6v(H2O) C. 2v(NH3)=3v(H2O) D. 4v(O2)=5v(NO)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用辉铜矿(主要成分为Cu2S,含少量Fe2O3、SiO2等杂质)制备Cu2(OH)2CO3,其工艺流程如下:

(1)“酸浸”过程中,将矿石粉碎,其目的是__________;加热能加快矿石粉“酸浸”速率,但温度不宜过高,其原因是__________。
(2)Cu2S和硝酸反应,其还原产物为NO。已知1 mol Cu2S完全反应时转移10 mol电子。写出该反应的离子方程式:_____________________。
(3)“除铁”中加入过量氧化铜发生反应的离子方程式为___________________。
(4)从过滤3得到的滤液中可提取一种肥料,它的化学式为__________;滤渣1的主要成分是__________(填化学式)。
(5)设计实验确认过滤2得到的滤液中是否有Fe3+:___________________________。
(6)取wg辉铜矿经上述流程转化,加入agCuO,滤渣2含bgCuO,最终得cmolCu2(OH)2CO3不考虑铜元素损失)。原辉铜矿含Cu2S的质量分数为____________。(用代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属Co、Ni性质相似,在电子工业以及金属材料上应用十分广泛.现以含钴、镍、铝的废渣(含主要成分为CoO、Co2O3、Ni、少量杂质Al2O3)提取钴、镍的工艺如下:
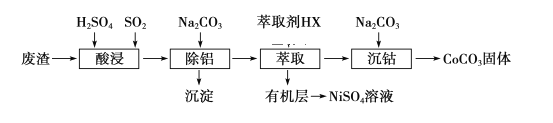
(1)酸浸时SO2的作用是___________________________________。
(2)除铝时加入碳酸钠产生沉淀的离子反应_________________________________。
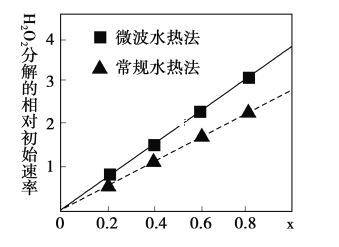
(3)用CoCO3为原料采用微波水热法和常规水热法均可制得H2O2分解的高效催化剂CoxNi(1-x)Fe2O4(其中Co、Ni均为+2价).如图是用两种不同方法制得的CoxNi(1-x)Fe2O4 在10℃时催化分解6%的H2O2 溶液的相对初始速率随x 变化曲线.
①H2O2 的电子式_________________________________。
②由图中信息可知:_________________________________法制取的催化剂活性更高。
③Co2+ 、Ni2+ 两种离子中催化效果更好的是_________________________________。
(4)已知煅烧CoCO3时,温度不同,产物不同.在400℃充分煅烧CoCO3,得到固体氧化物的质量2.41g,CO2的体积为0.672L(标况下),则此时所得固体氧化物的化学式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物在工农业生产中具有重要作用.
(1)某小组进行工业合成氨![]() 的模拟研究,在1L密闭容器中,分别加入0.1molN2和0.3molH2,实验
的模拟研究,在1L密闭容器中,分别加入0.1molN2和0.3molH2,实验![]() 、
、![]() 、
、![]() 中
中![]() 随时间
随时间![]() 的变化如图所示.
的变化如图所示.

实验![]() 从开始到达到平衡状态的过程中,用
从开始到达到平衡状态的过程中,用![]() 表示的平均反应速率为 ___________.与实验
表示的平均反应速率为 ___________.与实验![]() 相比.实验
相比.实验![]() 所采用的实验条件可能为 ___________
所采用的实验条件可能为 ___________![]() 填字母
填字母![]() ,实验
,实验![]() 所采用的实验条件可能为 ___________
所采用的实验条件可能为 ___________![]() 填字母
填字母![]() .
.
![]() 增大压强
增大压强 ![]() 减小压强
减小压强 ![]() 升高温度
升高温度 ![]() 降低温度
降低温度 ![]() 使用催化剂
使用催化剂
(2)![]() 可用于处理废气中的氮氧化物,其反应原理为2NH3(g)+ NO(g)+ NO2(g)
可用于处理废气中的氮氧化物,其反应原理为2NH3(g)+ NO(g)+ NO2(g)![]() 2N2(g)+ 3H2O(g) △H<0,欲提高废气中氮氧化物的转化率,可采取的措施是 ___________
2N2(g)+ 3H2O(g) △H<0,欲提高废气中氮氧化物的转化率,可采取的措施是 ___________![]() 填字母
填字母![]()
![]() 升高温度
升高温度 ![]() 增大压强 c,增大
增大压强 c,增大![]() 的浓度
的浓度
(3)![]() 遇水发生水解反应,生成
遇水发生水解反应,生成![]() 的同时得到 ___________
的同时得到 ___________![]() 填化学式
填化学式![]() 是广谱高效消毒剂,制备原理为
是广谱高效消毒剂,制备原理为![]() 若转移1mol电子,则制取
若转移1mol电子,则制取![]() 的质量为 ___________.
的质量为 ___________.
(4)![]() 时,将
时,将![]() 的氨水与
的氨水与![]() 盐酸等体积混合,反应后溶液恰好显中性,则a ___________
盐酸等体积混合,反应后溶液恰好显中性,则a ___________![]() 填“
填“![]() ”、“
”、“![]() ”或“
”或“![]() ”
”![]() 用a、b表示
用a、b表示![]() 的电离平衡常数为 ___________.
的电离平衡常数为 ___________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活、生产密切相关,下列说法错误的是 ( )
A. Ge(32号元素)的单晶可以作为光电转换材料用于太阳能电池
B. 工业生产玻璃、水泥,均需要用石灰石为原料
C. 将二氧化硫添加于红酒中可以起到杀菌和抗氧化作用
D. 纳米铁粉和FeS都可以高效地去除被污染水体中的Pb2+、Cu2+、Cd2+、Hg2+等重金属离子,其原理是相同的。
查看答案和解析>>
科目:高中化学 来源: 题型:
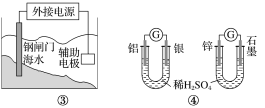
【题目】关于下列各装置图的叙述不正确的是( )
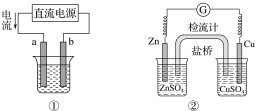
A.用图①装置实现铁上镀铜,a极为铜,电解质溶液可以是CuSO4溶液
B.图②装置盐桥中KCl的Cl-移向右烧杯
C.图③装置中钢闸门应与外接电源的负极相连获得保护
D.图④两个装置中通过导线的电子数相同时,消耗负极材料的物质的量不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素W、X、Y、Z的原子序数依次增加。A是元素Y的单质。常温下,甲的浓溶液和A发生钝化。丙、丁、戊是由这些元素组成的二元化合物,且丙是无色气体。上述物质的转化关系如图所示。下列说法正确的是
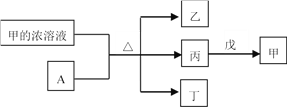
A. 丁和戊中所含元素种类相同
B. 简单离子半径大小:X<Y
C. 气态氢化物的还原性:X>Z
D. Y的简单离子与Z的简单离子在水溶液中可大量共存
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D四种物质之间有下图所示的转化关系。
已知:A是气体单质,C 是红棕色气体。

回答下列问题:
(1)写出C的化学式:________;
(2)在上图D→B的过程中,D表现出强_____(填“氧化性”或“还原性”);
(3)写出C→D转化的化学方程式__________________________________
(4)D→B的离子方程式_____________________________________________
(5)C 是红棕色气体,若A是气态氢化物,则A的电子式为___________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com