
| ||
| ||
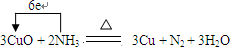 ,故答案为:
,故答案为: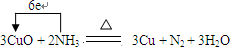 ;N2;
;N2;

科目:高中化学 来源: 题型:
- 3 |
- 3 |
2- 3 |
| A、加热、平衡①、②可能都向左移动 |
| B、加入澄清石灰水,平衡①、②均向右移动 |
| C、加入CaCO3悬浊液,CaCO3的溶解平衡向正方向移动 |
| D、通入过量CO2或滴加氯水,溶液PH均减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaHSO3溶液中投入过氧化钠粉末:4HSO3-+2Na2O2═4SO32-+O2↑+4Na+ |
| B、Na2O2与水反应:2O22-+2H2O═4OH-+O2↑ |
| C、向FeBr2溶液中通入少量Cl2:2Fe2++Cl2═2Fe3++2Cl- |
| D、向次氯酸钙溶液中通入过量CO2:Ca2++2ClO-+CO2+H2O═CaCO3↓+2HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:
 ,根据下列叙述,填写以下内容:
,根据下列叙述,填写以下内容:查看答案和解析>>
科目:高中化学 来源: 题型:
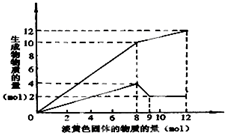 某溶液中可能含有Fe2+、Mg2+、Cu2+、NH4+、Al3+中的一种或几种.当加入一种淡黄色固体并加热溶液时,有刺激性气体放出和白色沉淀生成,加入淡黄色固体的物质的量(横坐标)与析出沉淀和产生气体的物质的量(纵坐标)的关系,如图所示.请填写下列空白:
某溶液中可能含有Fe2+、Mg2+、Cu2+、NH4+、Al3+中的一种或几种.当加入一种淡黄色固体并加热溶液时,有刺激性气体放出和白色沉淀生成,加入淡黄色固体的物质的量(横坐标)与析出沉淀和产生气体的物质的量(纵坐标)的关系,如图所示.请填写下列空白:查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

| 实验 序号 | 实验操作 | 现象 |
| Ⅰ | 将氯水滴入品红溶液 | ① |
| Ⅱ | 氯水中加入碳酸氢钠粉末 | 有无色气泡产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com