
���� �ŵ�ʱ������ӦΪ��CH3OH-6e-+8OH-=CO32-+6H2O�������缫��Ӧʽ��O2+2H2O+4e-=4OH-����ط�ӦΪ2CH3OH+3O2+4OH-=2CO32-+6H2O���������ʵ�ȼ�ϵ�أ�ͨ������ĵ缫�������õ������������ӣ�
��� �⣺�ٷŵ�����У��״���ȫ����������CO2�������������CO32-����Ӧ���ܷ���ʽΪ2CH3OH+3O2+4OH-=2CO32-+6H2O��
�ʴ�Ϊ��2CH3OH+3O2+4OH-=2CO32-+6H2O��
�ڷŵ�ʱ���״���������ӦΪ��ظ�����Ӧ�����ܷ�Ӧʽ2CH3OH+3O2+4OH-=2CO32-+6H2O����֪����OH-���������ҺpH���ͣ�
�ʴ�Ϊ��������С��
�۹������ʵ�ȼ�ϵ�أ�ͨ������ĵ缫�������õ������������ӣ���缫��ӦΪO2+4e-=2O2-��
�ʴ�Ϊ��O2+4e-=2O2-��
���� �����ۺϿ���ԭ��ع���ԭ������Ŀ�Ѷ��еȣ�ע����������Ϣ��ȷ��д�缫����ʽΪ������Ĺؼ�������ʱע�����缫����ʽ����д��ѧϰ��ע�������д������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
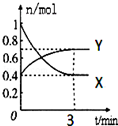 ��һ���¶��£����Ϊ2L���ܱ������У�NO2��N2O4֮�䷢����Ӧ��2NO2��g��������ɫ��?N2O4��g������ɫ������ͼ��ʾ��
��һ���¶��£����Ϊ2L���ܱ������У�NO2��N2O4֮�䷢����Ӧ��2NO2��g��������ɫ��?N2O4��g������ɫ������ͼ��ʾ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
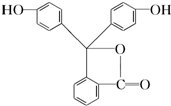
| A�� | 1 | B�� | 2 | C�� | 3 | D�� | 5 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������������ | B�� | �������������� | ||
| C�� | ������������������ | D�� | ����������������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

| �������� | Fe��OH��3 | Fe��OH��2 | Cu��OH��2 | Zn��OH��2 |
| ��ʼ������pH | 1.5 | 6.5 | 4.2 | 5.4 |
| ������ȫ��pH | 3.3 | 9.7 | 6.7 | 8.2 |
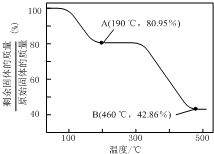
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Cl2 | B�� | NaCl | C�� | H2O | D�� | NaOH |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 0.08 mol•L-1•s-1 | B�� | 0.04 mol•L-1•s-1 | ||
| C�� | 0.8 mol•L-1•s-1 | D�� | 0.04 mol•L-1 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com