
 CO气体还原FeO固体可以得到Fe固体,铁的化合物具有重要的应用.
CO气体还原FeO固体可以得到Fe固体,铁的化合物具有重要的应用.分析 Ⅰ.根据盖斯定律进行计算;
Ⅱ.(1)化学平衡常数K=$\frac{c(CO)}{c(C{O}_{2})}$;该反应是吸热反应,升高温度平衡正向移动;
(2)①v(CO)=$\frac{△c}{△t}$;根据CO和二氧化碳之间的关系式计算参加反应的二氧化碳的物质的量浓度,从而确定二氧化碳初始浓度,从而计算其转化率;
②升高温度,平衡正向移动,则达到平衡状态时二氧化碳浓度小于0.5mol/L,反应到达平衡的时间缩短;
(3)能使平衡时$\frac{c(CO)}{c(C{O}_{2})}$增大,可以采用升高温度、增加CO的方法;
Ⅲ.(1)FeS和汞离子反应生成更难溶的HgS;
(2)FeCl3在水中发生水解生成氢氧化铁胶体,能吸附水中悬浮物而净水.
解答 解:Ⅰ.2FeO(s)=2Fe(s)+O2(g)△H=+148.2kJ/mol①
2CO(g)+O2(g)=2CO2(g)△H=-566.0kJ/mol②
将方程式$\frac{①+②}{2}$得FeO(s)+CO(g)=Fe(s)+CO2(g)△H=$\frac{+148.2-566.0}{2}$kJ/mol=-208.9kJ/mol
故答案为:FeO(s)+CO(g)=Fe(s)+CO2(g)△H=-208.9kJ/mol;
Ⅱ.(1)该反应平衡常数K=$\frac{c(CO)}{c(C{O}_{2})}$;
根据I知,Fe和二氧化碳的反应是放热反应,则FeO和CO的反应是吸热反应,升高温度平衡正向移动,则平衡常数增大,
故答案为:$\frac{c(CO)}{c(C{O}_{2})}$;吸热;增大;
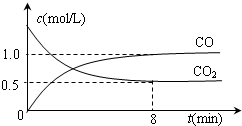
(2)①v(CO)=$\frac{△c}{△t}$=$\frac{1.0-0}{8}$ mol/(L•min)=0.125 mol/(L•min);根据CO和二氧化碳之间的关系式知,参加反应的c(CO2)=c(CO)=(1.0-0)mol/L=1.0mol/L,则二氧化碳初始浓度=(1.0+0.5)mol/L=1.5mol/L,所以二氧化碳转化率=$\frac{1.0mol/L}{1.5mol/L}×100%$=66.7%;
故答案为:0.125 mol/(L•min);66.7%;
②升高温度,平衡正向移动,则达到平衡状态时二氧化碳浓度小于0.5mol/L,反应到达平衡的时间缩短,所以其图象为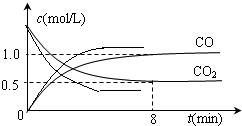 ,
,
故答案为: ;
;
(3)A.该反应的正反应是吸热反应,升高温度平衡正向移动,所以平衡时$\frac{c(CO)}{c(C{O}_{2})}$增大,故正确;
B.该反应的反应前后气体体积之和不变,所以增大压强平衡不移动,则平衡时$\frac{c(CO)}{c(C{O}_{2})}$不变,故错误;
C.充入一定量CO,平衡逆向移动,但加入的CO物质的量远远大于转化的CO的量,所以平衡时$\frac{c(CO)}{c(C{O}_{2})}$增大,故正确;
D.铁粉是固体,再加入一些铁粉,不影响平衡移动,所以平衡时$\frac{c(CO)}{c(C{O}_{2})}$不变,故错误;
故选AC;
Ⅲ.(1)FeS和汞离子反应生成更难溶的HgS,离子方程式为FeS(s)+Hg2+=Fe2++HgS(s),
故答案为:FeS(s)+Hg2+=Fe2++HgS(s);
(2)FeCl3在水中发生水解,Fe3++3H2O?Fe(OH)3+3H+生成氢氧化铁胶体,胶体具有吸附性,能够吸附水中的杂质,因此可以净水,
故答案为:FeCl3在水中发生水解,Fe3++3H2O?Fe(OH)3+3H+生成氢氧化铁胶体,胶体具有吸附性,能够吸附水中的杂质,因此可以净水.
点评 本题考查物质的量浓度随时间变化曲线、盐类水解、难溶物的溶解平衡及转化、化学平衡计算及平衡影响因素等知识点,综合性较强,侧重考查基本理论,注意II题反应方程式特点,压强只影响反应速率不影响平衡移动,题目难度不大.


科目:高中化学 来源: 题型:多选题
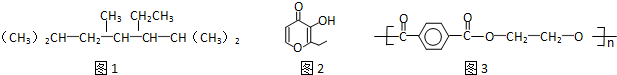
| A. | 按系统命名法命名时,(图1)化合物的名称是2,4,6-三甲基-3-乙基庚烷 | |
| B. | 有机物(图2)的一种芳香族同分异构体能发生银镜反应 | |
| C. | 高分子化合物(图3),其单体为对苯二甲酸和乙醇 | |
| D. | 前期在西非国家爆发的埃博拉疫情极具蔓延之势,已知该病毒对化学药品敏感.乙醇、次氯酸钠溶液均可以将病毒氧化而达到消毒的目的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 自然界中含有大量的游离态的硅,纯净的硅晶体可用于制作计算机芯片 | |
| B. | 工业上通常用电解钠、镁、铝对应的氯化物制得该三种金属单质 | |
| C. | Si、P、S、Cl相应的氢化物的还原性依次增强 | |
| D. | 测定相同条件下NaHCO3溶液和Na2SO4溶液的pH,判断碳与硫的非金属性强弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 金属钠与水反应:Na+H2O═Na++OH-+H2↑ | |
| B. | 铜粉溶于氯化铁溶液中:Cu+2Fe3+═2Fe2++Cu2+ | |
| C. | 氯气与冷氢氧化钠溶液反应:Cl2+2OH-═Cl-+ClO-+H2O | |
| D. | 向氯化铝溶液中加入过量氨水:4OH-+Al3+═AlO2-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素Y、P的简单氢化物中化学键类型相同 | |
| B. | 原子半径:X>Y | |
| C. | 最高价氧化物的水化物酸性:P<Q | |
| D. | X、Q两元素的最高正化合价相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.8g铁粉在1.12L(标准状态)氯气中充分燃烧,失去的电子数为0.15NA | |
| B. | 常温下,0.1mol/LHCl溶液中所含的H+个数为0.1NA | |
| C. | 11.2L 的CO气体与0.5molN2所含的电子数相等 | |
| D. | 10gH218O中所含的中子数为5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
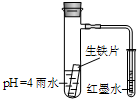 如图装置中,小试管内为红墨水,具支试管内盛有pH=4的雨水和生铁片.观察:开始导管内液面下降,一段时间后导管内液面回升,略高于小试管液面.以下有关解释合理的是( )
如图装置中,小试管内为红墨水,具支试管内盛有pH=4的雨水和生铁片.观察:开始导管内液面下降,一段时间后导管内液面回升,略高于小试管液面.以下有关解释合理的是( )| A. | 生铁片中的碳是原电池的阳极,发生氧化反应 | |
| B. | 雨水酸性较强,生铁片仅发生析氢腐蚀 | |
| C. | 导管内液面回升时,碳极反应式为:O2+4e-+2H2O=4OH- | |
| D. | 具支试管中溶液pH逐渐减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学是一门以实验为基础的自然科学 | |
| B. | 化学为解决环境、能源和资源等问题提供更多的有效途径 | |
| C. | 化学不支持高新技术的快速发展 | |
| D. | 学好化学的关键是掌握实验方法以及完成化学实验所必需的技能 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com