
| A. | “另一种反应物”一定具有还原性 | B. | “另一种反应物”一定只具有氧化性 | ||
| C. | 2CuH+3Cl2 $\frac{\underline{\;点燃\;}}{\;}$2CuCl2+2HCl | D. | CuH既可作氧化剂也可作还原剂 |
分析 A.Cu元素的化合价由+2价降低为+1价,在反应中CuSO4作氧化剂;
B.氧化还原反应中,氧化剂具有氧化性,还原剂具有还原性;
C.CuH跟氯气反应生成CuCl2和HCl;
D.氧化还原反应中,既能升高又能降低,既可作氧化剂也可作还原剂.
解答 解:A.Cu元素的化合价由+2价降低为+1价,在反应中CuSO4作氧化剂,则“另一种反应物”在反应中作还原剂,一定具有还原性,故A正确;
B.Cu元素的化合价由+2价降低为+1价,在反应中CuSO4作氧化剂,则“另一种反应物”在反应中作还原剂,具有还原性,故B错误;
C.CuH跟氯气反应生成CuCl2和HCl,则点燃时的方程式为:2CuH+3Cl2$\frac{\underline{\;点燃\;}}{\;}$2CuCl2+2HCl,故C正确;
D.CuH中Cu元素为+1价,既能升高又能降低,所以CuH既可做氧化剂也可做还原剂,故D正确;
故选B.
点评 本题考查氧化还原反应,注意利用信息及反应中元素的化合价变化来解答,题目难度不大,注重知识的迁移应用.


科目:高中化学 来源: 题型:解答题

 ;
;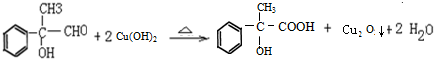 .
.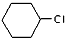 为原料合成重要的化工产品
为原料合成重要的化工产品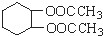 的路线流程图(无机试剂任选)
的路线流程图(无机试剂任选)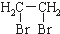
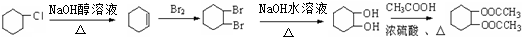 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | d元素的非金属性最强 | |
| B. | 它们均存在两种或两种以上的氧化物 | |
| C. | a可与c、d元素分别形成离子化合物 | |
| D. | b、c、d在化学反应中均易得到电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单质能与水反应生成强碱的金属元素都在ⅠA族 | |
| B. | L层上的电子数为奇数的元素一定是主族元素 | |
| C. | 稀有气体元素原子的最外层电子数均为8 | |
| D. | 元素周期表有18个纵行,分列16个族,即7个主族、8个副族和一个零族 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A原子的最外层电子数比B原子最外层电子数少 | |
| B. | 常温下,A能从冷水中置换出氢气,而B不能 | |
| C. | 等物质的量A和B与足量稀硫酸反应,产生氢气的量A比B多 | |
| D. | A原子的电子层数比B原子电子层数多 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 NH4++OH-;实验室制备A的氢化物的化学方程式为Ca(OH)2+2NH4Cl $\frac{\underline{\;\;△\;\;}}{\;}$ CaCl2+2NH3↑+2H2O.
NH4++OH-;实验室制备A的氢化物的化学方程式为Ca(OH)2+2NH4Cl $\frac{\underline{\;\;△\;\;}}{\;}$ CaCl2+2NH3↑+2H2O.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com