
工业上常用氨碱法制取碳酸钠(将氨气和二氧化碳先后通入饱和食盐水而析出小苏打,再经过滤、焙烧而得到纯碱),但却不能用氨碱法制碳酸钾,这是因为在溶液中 ( )。
A.KHCO3溶解度较大
B.KHCO3溶解度较小
C.K2CO3溶解度较大
D.K2CO3溶解度较小
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:
在5L的密闭容器中充入2molA气体和1molB气体,在一定条件下发生反应:
2A(g)+B(g) 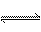 2C(g),经4 s后达到平衡状态,在相同温度下测得容器内混合气体的压强是反应前的5/6,
2C(g),经4 s后达到平衡状态,在相同温度下测得容器内混合气体的压强是反应前的5/6,
(1)达到平衡时,C的物质的量浓度;
(2)以B表示的该反应的速率;
(3)达到平衡时,A的转化率。
查看答案和解析>>
科目:高中化学 来源: 题型:
将0.05 mol·L-1的盐酸和未知浓度的NaOH溶液以12的体积比混合后,pH=12。用上述NaOH溶液滴定pH=3的一元弱酸HA的溶液20 mL,达到终点时消耗NaOH溶液12.5 mL。求:
(1)NaOH溶液的物质的量浓度。
(2)一元弱酸HA的物质的量浓度。
(3)一元弱酸HA的电离平衡常数。
查看答案和解析>>
科目:高中化学 来源: 题型:
铝生产产业链由铝土矿开采、氧化铝制取、铝的冶炼和铝材加工等环节构成。请回答下列问题:
(1)工业上采用电解氧化铝—冰晶石(Na3AlF6)熔融体的方法冶炼得到金属铝:
2Al2O3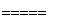 4Al+3O2↑
4Al+3O2↑
加入冰晶石的作用:____①____。
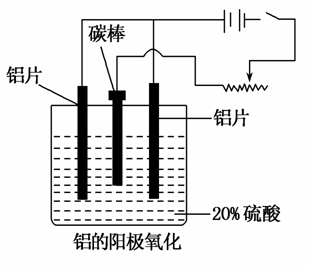
(2)上述工艺所得铝材中往往含有少量Fe和Si等杂质,可用电解方法进一步提纯,该电解池中阳极的电极反应式为________②________,下列可作阴极材料的是____③____。
A.铝材 B.石墨
C.铅板 D.纯铝
(3)阳极氧化能使金属表面生成致密的氧化膜。以稀硫酸为电解液,铝阳极发生的电极反应式为____④________。
(4)在铝阳极氧化过程中,需要不断地调整电压,理由是____⑤________。
(5)下列说法正确的是____⑥____。(填选项字母)
A.阳极氧化是应用原电池原理进行金属材料表面处理的技术
B.铝的阳极氧化可增强铝表面的绝缘性能
C.铝的阳极氧化可提高金属铝及其合金的耐腐蚀性,但耐磨性下降
D.铝的阳极氧化膜富有多孔性,具有很强的吸附性能,能吸附染料而呈各种颜色
查看答案和解析>>
科目:高中化学 来源: 题型:
侯氏制碱法的步骤如下图:

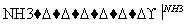

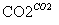


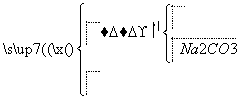
试回答下列问题:
(1)若上述的悬浊液是NaHCO3和NH4Cl的混合液,则Ⅰ和Ⅱ的总反应为
__________________________________________________________________
___________________________________________________________。
(2)由这一反应可知NaCl比NaHCO3溶解度______________________。
(3)Ⅲ的操作叫____________。
(4)Ⅳ的操作叫____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
对下列反应①KHCO3溶液与石灰水反应、②Na2SO3溶液与稀盐酸反应、③Si与烧碱溶液反应、④Fe与稀硝酸反应。改变反应物用量,不能用同一个离子方程式表示的是( )
A、①②③ B、①②④ C、①③④ D、②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
在恒温、体积为2 L的密闭容器中进行反应:2A(g)3B(g)+C(g),若反应物在前20 s由3 mol降为1.8 mol,则前20 s的平均反应速率为( )
A.v(B)=0.03 mol·L-1·s-1
B.v(B)=0.045 mol·L-1·s-1
C.v(C)=0.03 mol·L-1·s-1
D.v(C)=0.06 mol·L-1·s-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com