
【题目】无水MgBr2可用作催化剂。实验室采用镁屑与液溴为原料制备无水MgBr2,装置如图1,主要步骤如下:
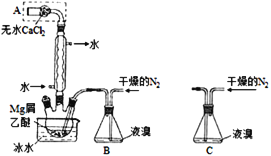
图1 图2
步骤1、三颈瓶中装入10g镁屑和150mL无水乙醚;装置B中加入15mL液溴;
步骤2、缓慢通入干燥的氮气,直至溴完全导入三颈瓶中;
步骤3、反应完毕后恢复至常温,过滤,滤液转移至另一干燥的烧瓶中,冷却至0℃,析出晶体,再过滤得三乙醚合溴化镁粗品;
步骤4、室温下用苯溶解粗品,冷却至0℃,析出晶体,过滤,洗涤得三乙醚合溴化镁,加热至160℃分解得无水MgBr2产品。
已知:①Mg与Br2反应剧烈放热;MgBr2具有强吸水性;
②MgBr2+3C2H5OC2H5![]() MgBr23C2H5OC2H5
MgBr23C2H5OC2H5
请回答:
(1)仪器A的名称是______;
(2)实验中不能用干燥空气代替干燥N2,原因是______________;
(3)步骤3中,第一次过滤除去的物质是_________________;
(4)有关步骤4的说法,正确的是__________________;
A.可用95%的乙醇代替苯溶解粗品 B.洗涤晶体可选用0℃的苯
C.加热至160℃的主要目的是除去苯 D.该步骤的目的是除去乙醚和可能残留的溴
(5)为测定产品的纯度,可用EDTA(简写为Y)标准溶液滴定,反应的离子方程式:Mg2++Y4﹣═MgY2
①滴定管洗涤前的操作是_______________________;
②测定时,先称取0.2500g无水MgBr2产品,溶解后,用0.0500molL﹣1的EDTA标准溶液滴定至终点,消耗EDTA标准溶液25.00mL,则测得无水MgBr2产品的纯度是__________(以质量分数表示)。
【答案】干燥管 防止镁屑与氧气反应,生成的MgO阻碍Mg和Br2的反应 镁屑 BD 检漏 92%
【解析】
(1)根据装置图,结合常见仪器的结构回答;
(2)实验中使用了镁屑,结合镁的化学性质分析解答;
(3)根据实验步骤,结合涉及物质的性质分析判断;
(4)根据溴化镁有强烈的吸水性,结合题干实验步骤分析解答;
(5)①根据滴定管的使用注意事项分析判断;②依据方程式Mg2++Y4-═MgY2-,计算出溴化镁的物质的量和质量,再计算溴化镁的产品的纯度。
(1)根据装置图,仪器A为干燥管,故答案为:干燥管;
(2)本实验要用镁屑和液溴反应生成溴化镁,所以装置中不能有能与镁反应的气体,例如氧气,所以不能用干燥的空气代替干燥的氮气,故答案为:防止镁屑与氧气反应生成的氧化镁阻碍Mg和Br2的反应;
(3)步骤3过滤出去的是不溶于水的镁屑,故答案为:镁屑;
(4)A.95%的乙醇中含有水,溴化镁有强烈的吸水性,故A错误;B.加入苯的目的是除去乙醚和溴,洗涤晶体用0°C的苯,可以减少产品的溶解,故B正确;C.加热至160°C的主要目的是分解三乙醚合溴化镁得到溴化镁,不是为了除去苯,故C错误;D.该步骤是为了除去乙醚和溴,故D正确;故答案为:BD;
(5)①滴定管使用前需要检查滴定管是否漏液,因此洗涤前的操作是,故答案为:检漏;
②依据方程式Mg2++Y4-═MgY2-分析,溴化镁的物质的量=0.0500mol/L×0.025L=0.00125mol,则溴化镁的质量为0.00125mol×184g/mol=0.23g,溴化镁的产品的纯度=![]() ×100%=92%,故答案为:92%。
×100%=92%,故答案为:92%。


 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:
【题目】有关催化剂的催化机理等问题可从“乙醇催化氧化实验”得到一些认识,其实验装置如图所示,实验操作为:预先使棉花团浸透乙醇,并按照图装置好,在铜丝的中间部分加热,片刻后开始有节奏(间歇性)地鼓入空气,即可观察到明显的实验现象。
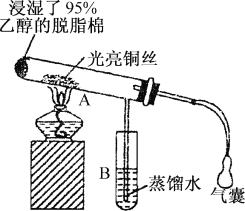
请回答以下问题:
(1)被加热的铜丝处发生反应的化学方程式为:________。
(2)从A管中可观察到_______的实验现象,从中可认识到在该实验过程中,催化剂起催化作用时参加了化学反应,还可认识到催化剂起催化作用时需要一定的_______。
(3)已知醇的氧化反应是放热反应,在实验进行一段时间后,如果只撤掉酒精灯,反应还能否继续进行?______;原受热的铜丝处有什么现象?_______。
(4)验证乙醇氧化产物的化学方法是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据了解,铜锈的成分非常复杂,主要成分有Cu2(OH)2CO3和Cu2(OH)3Cl。考古学家将铜锈分为无害锈(形成了保护层)和有害锈(使器物损坏程度逐步加剧,并不断扩散),结构如图所示。

下列说法正确的是
A. Cu2(OH)3Cl属于有害锈
B. Cu2(OH)2CO3属于复盐
C. 青铜器表面刷一层食盐水可以做保护层
D. 用NaOH溶液法除锈可以保护青铜器的艺术价值,做到“修旧如旧”
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】俗称“一滴香”的有毒物质被人食用后会损伤肝脏,还能致癌.“一滴香”的分子结构如图所示,下列说法正确的是( )

A. 该有机物的分子式为C7H7O3
B. 该有机物能发生取代、加成和氧化反应
C. 1mol该有机物最多能与2mol H2发生加成反应
D. 该有机物的一种含苯环的同分异构体能发生银镜反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在100g浓度为ω%的稀硫酸中加入4g氧化铜粉末,待氧化铜全部溶解后,向所得蓝色溶液中加入10g铁粉,充分反应后,过滤,得滤液和4.8g滤渣.下列计算结果正确的是
A.4.8g滤渣是由3.2g铜和1.6g铁组成B.ω=14.7
C.反应过程中产生的氢气是2.24LD.滤液是20.88%的硫酸亚铁溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下述实验中均有红棕色气体产生,对比分析所得结论不正确的是( )
|
|
|
① | ② | ③ |
A.由①中的红棕色气体,推断产生的气体一定是混合气体
B.红棕色气体不能表明②中木炭与浓硝酸发生了反应
C.由③说明浓硝酸具有挥发性,生成的红棕色气体为还原产物
D.③的气体产物中检测出CO2,由此说明木炭一定与浓硝酸发生了反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】明矾[KAl(SO4)212H2O]在生产、生活中有广泛用途:饮用水的净化;造纸工业上作施胶剂;食品工业的发酵剂等。利用炼铝厂的废料 — 铝灰(含 Al、Al2O3 及少量 SiO2 和 FeOxFe2O3)可制备明矾。工艺流程如下:

回答下列问题:
(1)欲配制 480 ml 1.0 mol / L H2SO4 溶液,需要 18 mol / L H2SO4 溶液的体积是 _______,已有下列仪器:烧杯,量筒,胶头滴管,玻璃棒,还需用到的仪器是 _____________。
(2)“酸浸”过程中“,酸浸铁”发生反应的离子方程式是 ______________。
(3)明矾净水的原理是 _____________(用离子方程式表示)。
(4)检验滤液 A 中是否存在 Fe2+ 的实验操作是 __________________。
(5)在滤液 A 中加入高锰酸钾溶液的目的是 ________________(用离子方程式表示)(该条件下 MnO4- 转化为 Mn2+)
(6)已知:加入 MnSO4,Mn2+ 可与 MnO4- 反应生成 MnO2,该反应氧化剂与还原剂的物质的量之比为 ____________。
(7)操作Ⅱ是 ___________、__________、过滤、洗涤、干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把0.6molW气体和0.5molX气体混合于2L密闭容器中,使它们发生如下反应:4W(g)+3X(g) ![]() 2Y(g)+nZ(g)。2min末已生成0.2mol Y,若测知以Z的浓度变化表示的反应速率为0.0025mol/(L·s),试计算
2Y(g)+nZ(g)。2min末已生成0.2mol Y,若测知以Z的浓度变化表示的反应速率为0.0025mol/(L·s),试计算
(1)前2min内用W的浓度变化表示的平均反应速率为_______________。
(2)2min末时X的浓度为_____________________________。
(3)化学反应方程式中n=_____________________________。
(4)2min末,恢复到反应前温度,体系内压强是反应前压强的__________倍。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究某盐X(仅含四种元素,其摩尔质量小于300g/mol)设计并完成如下实验:
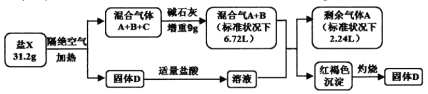
已知:气体A为单质,标准状况下的密度为1.25g/L。请回答:
(1)盐X的组成元素为H、O和____________(用元素符号表示)。
(2)写出固体D和过量HI溶液反应的离子方程式__________。
(3)写出盐X隔绝空气加热分解的化学方程式__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com