
| A、相同 | B、盐酸多 |
| C、醋酸多 | D、无法比较 |
 黄冈创优卷系列答案
黄冈创优卷系列答案科目:高中化学 来源: 题型:
| A、可用CaCl2溶液鉴别 |
| B、存在的粒子种类相同 |
| C、c(OH-)前者大于后者 |
| D、分别加入NaOH固体,恢复到原温度时,c(CO32-)均增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| c(OH-) |
| c(NH3?H2O) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na+、I-、CO32-、SO42- |
| B、Ca2+、H+、K+、HCO3- |
| C、Mg2+、Na+、SCN-、Cl- |
| D、Cu2+、Ba2+、Na+、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
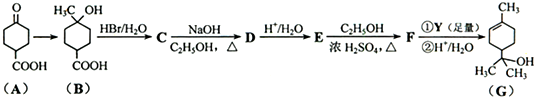
| ①R′MgBr(足量) |
| ②H+/H2O |

查看答案和解析>>
科目:高中化学 来源: 题型:
| 容器编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
| X(g) | Y(g) | Z(g) | ||
| Ⅰ | 387 | 0.20 | 0.080 | 0.080 |
| Ⅱ | 387 | 0.40 | 0.160 | 0.160 |
| Ⅲ | T | 0.20 | 0.090 | 0.090 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、3.36 | B、6.72 |
| C、4.48 | D、8.96 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 )与甲醛、氯化氢以物质的量之比1:1:1反应,可获得一种杀虫剂中间体X和H2O.
)与甲醛、氯化氢以物质的量之比1:1:1反应,可获得一种杀虫剂中间体X和H2O. 及X的核磁共振氢谱如图2,其中
及X的核磁共振氢谱如图2,其中 的核磁共振氢谱图.写出X的结构简式:
的核磁共振氢谱图.写出X的结构简式:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2 8克 |
| B、1.52克 |
| C、3.4克 |
| D、2克 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com