
| A. | NaOH | B. | NaCl | C. | HCl | D. | Ca(ClO)2 |
科目:高中化学 来源:2016-2017学年西藏拉萨中学高二上第一次月考化学试卷(解析版) 题型:填空题
用酸性KMnO4和H2C2O4(草酸)反应研究影响反应速率的因素,离子方程式为:2MnO4﹣+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O.一实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如下(KMnO4溶液已酸化):
实验序号 | A溶液 | B溶液 |
① | 20mL 0.1mol·L﹣1H2C2O4溶液 | 30mL 0.01mol·L﹣1KMnO4溶液 |
② | 20mL 0.2mol·L﹣ | 30mL 0.01mol·L﹣1KMnO4溶液[来 |
(1)该实验探究的是 因素对化学反应速率的影响.相同时间内针筒中所得CO2的体积大小关系是 > (填实验序号).
(2)若实验①在2min末收集了2.24mL CO2(标准状况下),则在2min末,c(MnO4﹣)= mol/L.
(3)除通过测定一定时间内CO2的体积来比较反应速率,本实验还可通过测定 来比较化学反应速率.
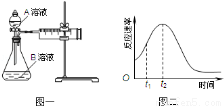
(4)小组同学发现反应速率总是如图二,其中t1~t2时间内速率变快的主要原因可能是: .
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(H+)>c(OH-) | B. | c(NH4+)+c(NH3•H2O)=0.2 mol•L-1 | ||
| C. | c(NH3•H2O)>c(NH4+) | D. | c(NH4+)+c(H+)=0.2 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 定容时俯视液面 | B. | 容量瓶洗净后有少量水残留 | ||
| C. | 转移时没有洗涤烧杯和玻璃 | D. | 所用的氢氧化钠已吸水潮解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸碱滴定管装标准溶液前,必须先用该溶液润洗 | |
| B. | 滴定过程中眼睛应注视滴定管内液面变化 | |
| C. | 锥形瓶用蒸馏水洗涤后直接盛放待测液,对滴定结果无影响 | |
| D. | 用50mL酸式滴定管可准确量取25.00LHCl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com