
以下是加热过程中发生的化学反应:CuSO4·5H2O![]() CuSO4+5H2O↑
CuSO4+5H2O↑
CuSO4![]() CuO+SO3↑
CuO+SO3↑
4CuO![]() 2Cu2O+O2↑
2Cu2O+O2↑
2SO3![]() 2SO2+O2
2SO2+O2
(1)充分反应后,最终固体产物颜色为___________,其质量为___________g。
(2)在某中间温度时,固体产物质量能否为10 g? ___________ (填“能”或“不能”)。如可能,请计算其组成和质量,如不可能,请说明理由:_________________________________。
(3)如果某同学在做此实验时,最后得到固体质量为7.6 g,试计算该固体的组成和质量。
(4)不考虑实验带来的误差,在该反应条件下最终生成气态产物除去水后,物质的量可能为( )
A.0.10 mol B.0.15 mol C.0.20 mol
(1)红色 7.2
(2)能 产物中有6 g CuO和4 g CuSO4
(3)Cu2O:3.6 g,CuO:4 g
(4)B
解析:(1)根据题意可得关系式:
2CuSO4·5H2O — Cu2O
2×250 144
25.0 g x
x=7.2 g
(2)若产物全部是CuSO4,则质量为16 g;若产物全部是CuO,则质量为8 g,所以10 g固体中含有CuSO4和CuO。设CuSO4和CuO的物质的量分别为x、y,则
![]()
解得:x=0.025 mol, y=0.075 mol,
即m(CuSO4)=0.025 mol×160 g·mol-1=4 g。
m(CuO)=0.075 mol×80 g·mol-1=6 g。
(3)若产物全部是CuO,则质量为8 g;若产物全部是Cu2O,则质量为7.2 g,所以7.6 g固体中含有CuO和Cu2O。设Cu2O和CuO的物质的量分别为a mol、b mol,则
![]()
解得a=0.025,b=0.05,
即m(Cu2O)=3.6 g,m(CuO)=4 g
(4)根据题意,4CuSO4·5H2O—4CuO—O2↑—4SO3↑,
4 1 4
0.10 mol 0.025 mol 0.10 mol
![]()
因此最终气态产物(除H2O外含O2、SO2)的物质的量n为0.125 mol<n<0.175 mol。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
以下是加热过程中发生的化学反应:
CuSO4·5H2O![]() CuSO4+5H2O↑
CuSO4+5H2O↑
CuSO4![]() CuO+SO3↑ 4CuO
CuO+SO3↑ 4CuO![]() 2Cu2O+O2↑
2Cu2O+O2↑
2SO3![]() 2SO2+O2
2SO2+O2
(1)充分反应后,最终固体产物颜色为____________,其质量为_________g。
(2)在某中间温度时,固体产物质量能否为10 g?_________(填“能”或“不能”)。如可能,请计算其组成和质量,如不可能,请说明理由___________________________________。
(3)如果某同学在做此实验时,最后得到固体质量为7.6 g,试计算该固体的组成和质量。
(4)不考虑实验带来的误差,在该反应条件下最终生成气态产物除去水后,物质的量可能为_________。
A.0.10 mol B.0.15 mol C.0.20 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
以下是加热过程中发生的化学反应:?
CuSO4·5H2O![]() CuSO4+5H2O↑?
CuSO4+5H2O↑?
CuSO4![]() CuO+SO3↑
CuO+SO3↑
4CuO![]() 2Cu2O+O2↑?
2Cu2O+O2↑?
2SO3![]() 2SO2+O2?
2SO2+O2?
(1)充分反应后,最终固体产物颜色为 ,其质量为 g。?
(2)在某中间温度时,固体产物质量能否为10 g? (填“能”或“不能”)。如可能,请计算其组成和质量,如不可能,请说明理由 。?
(3)如果某同学在做此实验时,最后得到固体质量为7.6 g,试计算该固体的组成和质量。(4)不考虑实验带来的误差,在该反应条件下最终生成气态产物除去水后,物质的量可能为 。?
查看答案和解析>>
科目:高中化学 来源:2012届江苏省阜宁高中、大丰高中、栟茶高中高三第二次调研联考化学试卷 题型:填空题
(12分)我国是个钢铁大国,钢铁产量为世界第一,高炉炼铁是最为普遍的炼铁方法。高炉内可能发生如下反应:
C(s)+O2(g) = CO2(g) △H1=-393.5 kJ·mol—1 ①
C(s)+CO2(g) = 2CO(g) △H2=+172.5 kJ·mol—1 ②
4CO(g )+Fe3O4(s) = 4CO2(g)+3Fe(s) △H3=-13.7 kJ·mol—1 ③
)+Fe3O4(s) = 4CO2(g)+3Fe(s) △H3=-13.7 kJ·mol—1 ③
请回答下列问题:
⑴计算3Fe(s)+2O2(g) = Fe3O4(s)的△H=___________________。
⑵8 00℃时,C(s)+CO2(g)
00℃时,C(s)+CO2(g) 2CO(g)的平衡常数K=1.64,相同条件下测得高炉内c(CO)=0.20 mol·L-1、c(CO2)=0.05 mol·L-1,此时反应向_______(填“正”或“逆”)方向进行。
2CO(g)的平衡常数K=1.64,相同条件下测得高炉内c(CO)=0.20 mol·L-1、c(CO2)=0.05 mol·L-1,此时反应向_______(填“正”或“逆”)方向进行。
⑶某种矿石中铁元素以氧化物FemOn形式存在,现进行如下实验:将少量铁矿石样品粉碎,称取25.0 g样品于烧杯中,加入稀硫酸充分溶解,并不断加热、搅拌,滤去不溶物。向所得滤液中加入10.0 g铜粉充分反应后过滤、洗涤、干燥得剩余固体3.6 g。剩下滤液用浓度为2 mol·L-1的酸性KMnO4滴定,至终点时消耗KMnO4溶液体积25.0 mL。
提示:2Fe3++Cu=2Fe2++Cu2+ 8H++MnO4-+5Fe2+=Mn2++5Fe3++4H2O
①计算该铁矿石中铁元素的质量分数。(请写出必要的解题步骤)
②计算氧化物FemOn的化学式(m、n为正整数)(请写出必要的解题步骤)
查看答案和解析>>
科目:高中化学 来源:2011届江苏省南通市高三第一次调研测试化学试卷 题型:计算题
我国是个钢铁大国,钢铁产量为世界第一,高炉炼铁是最为普遍的炼铁方法。高炉内可能发生如下反应:
C(s)+O2 (g) = CO2(g) △H1=-393.5 kJ·mol—1 ①
(g) = CO2(g) △H1=-393.5 kJ·mol—1 ①
C(s)+CO2(g) = 2CO(g) △H2=+172.5 kJ·mol—1 ②
4CO(g)+Fe3O4(s) = 4CO2(g)+3Fe(s) △H3=-13.7 kJ·mol—1 ③
请回答下列问题:
⑴计算3Fe(s)+2O2(g) = Fe3O4(s)的△H= ▲ 。
⑵800℃时,C(s)+CO2(g) 2CO(g)的平衡常数K=1.64,相同条件下测得高炉内c(CO)=0.20mol·L-1、c(CO2)=0.05mol·L-1,此时反应向 ▲ (填“正”或“逆”)方向进行。
2CO(g)的平衡常数K=1.64,相同条件下测得高炉内c(CO)=0.20mol·L-1、c(CO2)=0.05mol·L-1,此时反应向 ▲ (填“正”或“逆”)方向进行。
⑶某种矿石中铁元素以氧化物FemOn形式存在,现进行如下实验:将少量铁矿石样品粉碎,称取25.0 g样品于烧杯中,加入稀硫酸充分溶解,并不断加热、搅拌,滤去不溶物。向所得滤液中加入10.0 g铜
粉充分反应后过滤、洗涤、干燥得剩余固体3.6 g。剩下滤液用浓度为2mol·L-1的酸性KMnO4滴定,至终点时消耗KMnO4溶液体积25.0 mL。
提示:2Fe3++Cu=2Fe2++Cu2+ 8H++MnO4-+5Fe2+=Mn2++5Fe3++4H2O
①计算该铁矿石中铁元素的质量分数。
②计算氧化物FemOn的化学式(m、n为正整数)
查看答案和解析>>
科目:高中化学 来源:2011-2012学年江苏省高三第二次调研联考化学试卷 题型:填空题
(12分)我国是个钢铁大国,钢铁产量为世界第一,高炉炼铁是最为普遍的炼铁方法。高炉内可能发生如下反应:
C(s)+O2(g) = CO2(g) △H1=-393.5 kJ·mol—1 ①
C(s)+CO2(g) = 2CO(g) △H2=+172.5 kJ·mol—1 ②
4CO(g)+Fe3O4(s) = 4CO2(g)+3Fe(s) △H3=-13.7 kJ·mol—1 ③
请回答下列问题:
⑴计算3Fe(s)+2O2(g) = Fe3O4(s)的△H=___________________。
⑵800℃时,C(s)+CO2(g)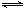 2CO(g)的平衡常数K=1.64,相同条件下测得高炉内c(CO)=0.20 mol·L-1、c(CO2)=0.05 mol·L-1,此时反应向_______(填“正”或“逆”)方向进行。
2CO(g)的平衡常数K=1.64,相同条件下测得高炉内c(CO)=0.20 mol·L-1、c(CO2)=0.05 mol·L-1,此时反应向_______(填“正”或“逆”)方向进行。
⑶某种矿石中铁元素以氧化物FemOn形式存在,现进行如下实验:将少量铁矿石样品粉碎,称取25.0 g样品于烧杯中,加入稀硫酸充分溶解,并不断加热、搅拌,滤去不溶物。向所得滤液中加入10.0 g铜粉充分反应后过滤、洗涤、干燥得剩余固体3.6 g。剩下滤液用浓度为2 mol·L-1的酸性KMnO4滴定,至终点时消耗KMnO4溶液体积25.0 mL。
提示:2Fe3++Cu=2Fe2++Cu2+ 8H++MnO4-+5Fe2+=Mn2++5Fe3++4H2O
①计算该铁矿石中铁元素的质量分数。(请写出必要的解题步骤)
②计算氧化物FemOn的化学式(m、n为正整数)(请写出必要的解题步骤)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com