
【题目】三种正盐的混合溶液中含有0.2molNa+ , 0.25molMg2+ , 0.4molCl﹣ , 则SO42﹣的物质的量为( )
A.0.1 mol
B.0.3 mol
C.0.5 mol
D.0.15 mol
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】铁、铜的单质及它们的化合物与我们的生产、生活紧密相关。
(1)Cu处于周期表中______区,其最高能层的符号为______,基态铜原子的价电子排布式为________。
(2)向硫酸铜溶液中逐滴滴加氨水,首先形成蓝色沉淀,继续滴加氨水。沉淀溶解,得到深蓝色透明溶液,向深蓝色溶液中加入乙醇,析出深蓝色晶体。
①写出沉淀溶解,得到深蓝色透明溶液的离子方程式:________。
②为什么加入乙醇,能够析出深蓝色晶体?________________
③为什么NH3常在配合物中作配体,而NH4+却不能作配体?_______。
(3)Fe3+可以与SCN-、CN-、H2NCONH2(尿素)等多种配体形成很多的配合物。
①请写出一种与SCN-互为等电子体的分子:________。
②CN-的电子式为________。
③H2NCONH2(尿素)中N、C原子的杂化方式分别为_______、_______,组成尿素的4种元素的第一电离能由大到小的顺序为__________。
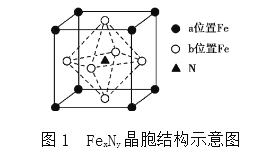
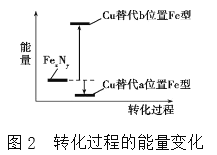
(4)某FeN,的晶胞如图1所示,Cu可以完全替代该晶体中a位置Fe或者b位置Fe,形成Cu替代型产物Fe(x-n)CunNy。FexNy转化为两种Cu替代型产物的能量变化如图2所示,其中更稳定的Cu替代型产物的化学式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常用浓氨水检查氯气管道是否泄漏,发生反应为:8NH3 +3C12=N2+6NH4C1, 该反应属于
A. 置换反应 B. 分解反应 C. 化合反应 D. 复分解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】天然气是一种重要的化工原料,可用来生产氢气和甲醇等高附加值化学品。回答下列问题:
(1)以天然气为原料制取氢气是工业上常用的制氢方法。
已知:
①CH4(g)+H2O(g) =CO(g)+3H2(g) ΔH1=a kJ·mol-1
②CH4(g)+CO2(g) =2CO(g)+2H2(g) ΔH2=b kJ·mol-1
③CH4(g)+2H2O(g)=CO2(g)+4H2(g) ΔH3
请计算上述反应中的反应热ΔH3=_________(用a、b表示)kJ·mol-1。
(2)合成甲醇的反应原理为:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) 在1L的密闭容器中,充入1mol CO2和3 mol H2,在500℃下发生反应,测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g) 在1L的密闭容器中,充入1mol CO2和3 mol H2,在500℃下发生反应,测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
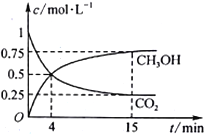
①反应进行到4 min 时,v(正)____ (填“>”“<”或“=”)v(逆)。0~4 min,CO2的平均反应速率v(CO2)=____________mol·L-1·min-1。
②CO2的平衡转化率为_______________,该温度下平衡常数为_____________。
③下列能说明该反应已达到平衡状态的是______________。
a.v正(CH3OH)=3v逆(H2)
b.CO2、H2、CH3OH和H2O浓度之比为1: 3 :1: 1
C.恒温恒压下,气体的体积不再变化
d.恒温恒容下,气体的密度不再变化
(3)在相同温度、相同容积的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
容器 | 容器1 | 容器2 | 容器3 |
反应物投入量 | 1mol CO2,3 mol H2 | 0.5mol CO2,1.5mol H2 | 1mol CH3OH,1mol H2O |
CH3OH的平衡浓度/mol·L-1 | c1 | c1 | c3 |
平衡时体系压强/Pa | p1 | p2 | p3 |
则下列各量的大小关系为c1_________(填“>”“<”或“=”,下同)c3,p2________p3。
(4)为提高燃料的能量利用率,常将其设计为燃料电池。某电池以甲烷为燃料,空气为氧化剂,熔融的K2CO3为电解质,以具有催化作用和导电性能的稀土金属为电极。写出该燃料电池的负极反应式:__________________________;为使电解质的组成保持稳定,使该燃料电池长时间稳定运行,在通入的空气中必须加入________________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温下,物质的量之比为2∶1的SO2和O2的混合气体在容积为2L的恒容密闭容器中发生反应:2SO2(g)+O2(g)![]() 2SO3(g)(正反应为放热反应),n(SO2)随时间变化关系如下表:
2SO3(g)(正反应为放热反应),n(SO2)随时间变化关系如下表:
时间/min | 0 | 1 | 2 | 3 | 4 | 5 |
n(SO2)/mol | 0.20 | 0.16 | 0.13 | 0.11 | 0.08 | 0.08 |
下列说法正确的是( )
A. 该反应进行到第3分钟时,逆反应速率大于正反应速率
B. 若要提高SO2的转化率,可用空气代替纯氧气并鼓入过量空气
C. 从反应开始到达到平衡,用SO3表示的平均反应速率为0.01mol/(L·min)
D. 容器内达到平衡状态时的压强与起始时的压强之比为5∶4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用压强传感器探究生铁在pH=2和pH=4醋酸溶液中发生腐蚀的装置及得到的图象如下:分析图象,以下结论错误的是( )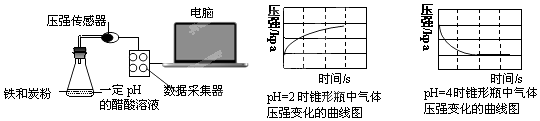
A.溶液pH≤2时,生铁发生析氢腐蚀
B.生铁的腐蚀中化学腐蚀比电化学腐蚀更普遍
C.在酸性溶液中生铁可能发生吸氧腐蚀
D.两溶液中负极反应均为:Fe﹣2e﹣═Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实与胶体性质无关的是( )
A.在豆浆里加入盐卤做豆腐
B.在河流入海口易形成沙洲
C.一束平行光线照射蛋白质溶液时,从侧面可以看到一条光亮的通路
D.三氯化铁溶液中滴入氢氧化钠溶液出现红褐色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了检验某溶液中是否含有常见的四种无机离子,某化学小组的同学进行了如下所示的实验操作。其中检验过程中产生的气体能使湿润的红色石蕊试纸变蓝。由该实验能得出的正确结论是( )

A.原溶液中一定含有SO42- B.原溶液中一定含有NH4+
C.原溶液中一定含有Cl- D.原溶液中一定含有Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验准备工作正确的是( )
A.将蒸发皿放置在铁架台的铁圈上,并垫石棉网加热
B.固体食盐盛装在细口试剂瓶内
C.结束氢气还原氧化铜的实验时,先熄灭酒精灯后撤出导管
D.将氢氧化钠溶液盛放在试剂瓶内,并用玻璃塞塞紧
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com