
����Ŀ�������£���1 mol��L-1NH4C1��Һ�м���������þ��������ϵpH��ʱ��仯��������ͼ��ʾ��ʵ��۲쵽b�㿪ʼ��Һ���а�ɫ�������ɡ�����˵��������ǣ� ��(��֪Ksp[Mg(OH)2]=1.8��10-11)

A.a����Һ�У�c(NH4+)+c(H+)��c(C1-)+c(OH-)
B.b��ʱ����Һ��c(Mg2+)=0.18 mol��L-1
C.��ϵ�У�ˮ�ĵ���̶ȴ�С��ϵΪa��c��b
D.�����£�NH4C1��ˮ��ƽ�ⳣ��������Ϊ10-10
���𰸡�C
��������
A��a����Һ�ĵ���غ�Ϊ��c(NH4+)+c(H+)+2c(Mg2+)=c(Cl-)+c(OH-)������c(NH4+)+ c(H+)��c(Cl-)+c(OH-)��A��ȷ��
B��b��ʱ��Ksp[Mg(OH)2]=1.8��10-11����ͼ��֪b��ʱpH=9����c(H+)=10-9 mol/L��c(OH-)=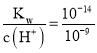 mol/L=10-5 mol/L������c(Mg2+)=
mol/L=10-5 mol/L������c(Mg2+)=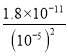 mol/L=0.18 mol/L��B��ȷ��
mol/L=0.18 mol/L��B��ȷ��
C����NH4+ˮ�⣺NH4++H2ONH3H2O+H+������þ����������Һ�е�H+��ʹƽ�������ƶ����ٽ���NH4+��ˮ�⣬ͬʱ�ٽ���ˮ�ĵ��룬����ˮ�ĵ���̶ȴ�С��ϵΪ��c��b��a��C����
D��NH4Cl�е�NH4+ˮ�⣺NH4++H2ONH3H2O+H+����Kh=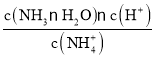 ����NH4+ˮ��ķ���ʽ�ó���c(NH3H2O)��c(H+)����������ͼ��û����þ֮ǰ��Һ��pH=5����c(NH3H2O)��c(H+)=10-5 mol/L����Kh=10-10������ˮ��ƽ�ⳣ����������Ϊ10-10��D��ȷ��
����NH4+ˮ��ķ���ʽ�ó���c(NH3H2O)��c(H+)����������ͼ��û����þ֮ǰ��Һ��pH=5����c(NH3H2O)��c(H+)=10-5 mol/L����Kh=10-10������ˮ��ƽ�ⳣ����������Ϊ10-10��D��ȷ��
�ʺ���ѡ����C��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2019��10��1Ի������ף�л���������70������ı���ʽ�ϣ���������DF-31A��ս�Ե������ҹ������λ������ʵ����������־�������������а�����Fe��Cr��Ni��C�ȶ���Ԫ�ء��ش��������⣺
��1����̬Crԭ�ӵļ۵����Ų�ʽΪ___��
��2��ʵ���ҳ���KSCN��Һ�����ӣ�![]() ������Fe3+��
������Fe3+��
����һ�����ܣ�N___O(������������<��)��
��1mol�����к��е�����ĿΪ___��
�������е���ԭ�Ӻ�̼ԭ�Ӿ�������ͬ���ӻ���ʽ��������Ϊ___��
���ӽṹ�ĽǶȷ������ӵķ��ǻ��������Ե�ԭ��Ϊ___��
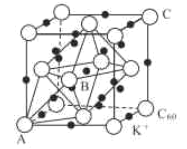
��3��̼��һ��ͬ��������ľ���ɲ�ȡ�����ܶѻ���Ȼ���ڿ�϶�в���������ӻ�ó����塣��ͼΪһ�ֳ��������������������C60����ռ�ݶ�������Ĵ���K+ռ�ݵ���C60����Χ�ɵ�___��϶��___��϶����οռ乹�ͣ�����C60���ӵ���������ֱ�ΪA(0��0��0)��B(![]() ��0��
��0��![]() )��C(1��1��1)�ȣ������Aλ������������ӵ�ԭ���������Ϊ___��
)��C(1��1��1)�ȣ������Aλ������������ӵ�ԭ���������Ϊ___��
��4��Ni�����γɶ������������һ��NiaO���徧���ṹΪNaCl�ͣ����ھ���ȱ�ݣ�a��ֵΪ0.88���Ҿ����е�Ni�ֱ�ΪNi2+��Ni3+������Ni2��Ni3+�������������Ϊ___����������Ϊ428pm�������ܶ�Ϊ___gcm-3(NA��ʾ�����ӵ�������ֵ���г�����ʽ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������ڷ��Ӿ�����ǣ�������
A. �۵���10.31����Һ̬�����磬ˮ��Һ�ܵ���
B. �۵���1070������̬�����磬����״̬�ܵ��磬������ˮ
C. �۵�3550����������ˮ��������
D. �۵���97.80������������̬�ɵ��磬�ܶ���0.97g��cm��3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪W��X��Y��Z��Ϊ������Ԫ�أ������£����ǵ�����������Ӧ��ˮ������Һ(Ũ�Ⱦ�Ϊ0.01mol��L-1)��pH��ԭ�Ӱ뾶��ԭ�������Ĺ�ϵ��ͼ��ʾ������˵����ȷ���ǣ� ��

A.������X2Y2�к��м��Թ��ۼ��ͷǼ��Թ��ۼ�
B.����̬�⻯������ȶ��ԣ�Y��W
C.�����Ӱ뾶��Z��Y��W��X
D.������Ԫ���У�Ԫ��X�ĵ�һ��������С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶�ʱ��BaSO4��ˮ�еij����ܽ�ƽ��������ͼ��ʾ������˵����ȷ����
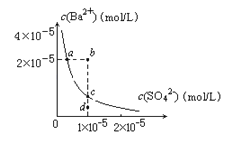
A. ����Na2SO4��ʹ��Һ��a��䵽b��
B. ͨ����������ʹ��Һ��d��䵽c��
C. d����BaSO4��������
D. a���Ӧ��Ksp����c���Ӧ��Ksp
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ����������̼�����ƺ��ȴ����Ĺ���������ͼ��ʾ��������NaHCO3�Ĺ����������ϩ�Ȼ�����������������ǣ� ��
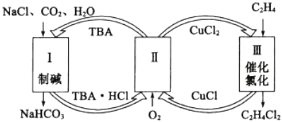
A.���̢��е�TBA����˺�°��Ƽ�еİ���
B.�ڹ��̢���ʵ����TBA��CuCl2������
C.���̢��еķ�Ӧ����ʽΪC2H4+2CuCl2![]() C2H4C12+2CuC1
C2H4C12+2CuC1
D.������ÿ����1 mol NaHCO3���ɵõ�1 mol C2H4C12
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ȼ���������Ҫ�Ļ�ԭ���������ڼ�����������ۺ��Ȼ��������������Ʊ�FeCl2�ķ����ж��֡���ش��������⣺
��.�ᾧ����ȡFeCl2
��һ��Ũ�ȵ������У������������м����ַ�Ӧ�����������־�Ĥ��____��______����Һ���룬ϴ�ӣ����ٸ����Ƶá�
��.�ȱ���ԭ��ˮFeC13��ȡFeC12
��ˮFeCl3���ȱ���Ӧ�Ļ�ѧ����ʽΪ��2FeCl3+C6H5Cl![]() 2FeCl2+C6H4Cl2+HCl��
2FeCl2+C6H4Cl2+HCl��
(1)��ͼ���ø����C12��������ȡ��ˮFeC13��װ�á�Ӳ�ʲ����ܺ��ռ����ô�ڹ����ӵ�ԭ����________��
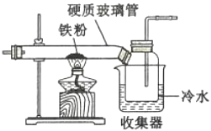
(2)������ͼװ���Ʊ���ˮFeC12�������FeC13��ת���ʡ���֪������ʵIJ����������£�

C6H5C1(�ȱ�) | C6H4C12 | FeC13 | FeC12 | |
��Է������� | 112.5 | 147 | 162.5 | 127 |
�۵�/�� | -45 | 53 | 306 | 670~674 |
�е�/�� | 132 | 173 | 315 | 1023 |
��162.5 g��ˮ�Ȼ�����200 g�ȱ����뵽Բ����ƿ�У�����ƿ�м���200 g���з�̪��9.5%��NaOH��Һ����ͨ��N2һ��ʱ�䣬�ټ��ȣ������¶���132 �����ҷ�����Ӧ��ʵ����ɺ���ȴ�������ᴿ�õ��ֲ�Ʒ��
����ͨ��N2��Ŀ����_______������a��������______��
�ڵ���ƿ����Һ��ɫ�ɺ�ɫ��Ϊ��ɫʱ��ֹͣ���ȣ����Ȼ���ת���������ϴﵽ��______%��
��ʵ��������չ����ȱ��IJ�������Ϊ______��
��ָ��װ��c���ܴ��ڵ�ȱ��______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й������������У�����ȷ���ǣ� ��

A.�����������У����еĻ�ѧ����Ϊ����
B.�����ڹ���������һ�㶼����Cl2����ȡ����Ӧ
C.��ͼ��ʾ����1��������4���Cl2�����Թ��У�
һ��ʱ�������ˮ�۵ײ�����״Һ�����ɣ��Թ��ڳ���ˮ
D.������Cl2�ڹ��������·�����Ӧ�IJ����У�HCl��ˮ���е�Ũ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ϵԪ��������������Ԫ�أ� Fe3+������KSCN��Һ�����ӵȷ�����ɫ���á�þԪ��Ҳ�������������������Ԫ��֮һ�����ܹ�ά�ֺ���ṹ���ȶ��ԣ����ڻ������߹��ܣ�������ֿ��¹ڲ����Ȳ�����Ϯ������Ҫ���á�
(1)Fe3+�Ļ�̬��������Ų�ʽΪ____________________��
(2)��SCN��Ϊ�ȵ�������Ϊ�Ǽ��Է��ӵĻ�ѧʽΪ__________����дһ�֣���
(3)��³ʿ���׳�������������ͼ����ʾ��K+δ��������ƽ��ÿ���������������к���һ��K+����֪�þ�������Ԫ����+2�ۺ�+3�����֣���Fe3+��Fe2+�ĸ�����Ϊ_________��

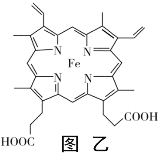
(4)Ѫ��������ͼ�ң�������ǿ�������������ʱ�һ��������3������ͼ���л���Fe2+��Nԭ�Ӽ�Ļ�ѧ����������λ������Ҫ�ü�ͷ���Ա�ʾ��______________
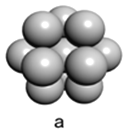
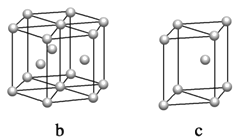
(5)þ���ʾ�����ԭ�ӵĶѻ�ģ����ͼ�����Ķѻ�ģ������Ϊ____________��������ͼ�е�_________________����a��b��c������λ����__________________�����ڵ��ĸ�þԭ�ӵ��������߹��ɵ��������弸����������2a cm3��þ���ʵ��ܶ�Ϊ�� g��cm��3����֪������������ΪNA����þ��Ħ�������ļ���ʽ��________________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com