
铅蓄电池是工作时的电池反应为:PbO2+2H2SO4⇌2PbSO4+2H2O;试回答:
(3)铅蓄电池正极的电极材料是 .
(4)工作时该铅蓄电池负极的电极反应是 .
科目:高中化学 来源: 题型:
下列仪器:①容量瓶,②蒸馏烧瓶,③漏斗,④燃烧匙,⑤天平,⑥分液漏斗,⑦胶头滴管,常用于混合物质分离的是()
A. ①③⑤ B. ②④⑦ C. ①②⑥ D. ②③⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
关于下列各实验装置的叙述中,不正确的是()
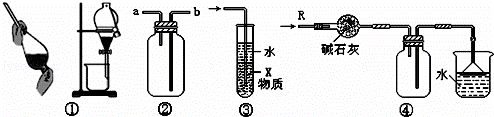
A. 装置①可用于分离C2H5OH和H2O的混合物
B. 装置②可用于收集H2、NH3、CO2、Cl2、HCl、NO2等气体
C. 装置③中X若为CCl4,可用于吸收NH3或HCl,并防止倒吸
D. 装置④可用于干燥、收集NH3,并吸收多余的NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
把锌片和铁片放在盛有稀食盐水和酚酞试液混合溶液的玻璃皿中(如图所示平面图),经过一段时间后,首先观察到溶液变红的区域是()
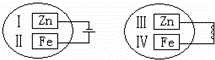
A. Ⅰ和Ⅲ附近 B. Ⅰ和Ⅳ附近 C. Ⅱ和Ⅲ附近 D. Ⅱ和Ⅳ附近
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是()
A. 工业上电解熔融的Al2O3冶炼铝用铁做阳极
B. 用惰性电极电解Na2SO4溶液,阴、阳两极产物的物质的量之比为1:2
C. 用惰性电极电解饱和NaCl溶液,若有1mol电子转移,则生成1mol NaOH
D. 用惰性电极电解浓CuSO4溶液一小段时间后,加入Cu2O固体可以使CuSO4溶液恢复原来浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
甲、乙、丙三种含不相同离子的可溶性强电解质,它们所含的离子如下表所示:
阳离子 NH4+、Na+、Mg2+
阴离子 OH﹣、NO3﹣、SO42﹣
若取等质量的甲、乙、丙配成相同体积的溶液,发现溶质的物质的量浓度c(甲)>c(乙)>c(丙),
则乙物质()
A. 可能是Na2S04 B. 可能是NH4NO3
C. 可能是NaOH D. 一定不是(NH4)2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
某研究性学习小组为了变废为宝,拟采用铅铬黄法对某电镀厂含铬废水进行处理,并生产出符合条件的铅铬黄(PbCrO4).设计实验如下:
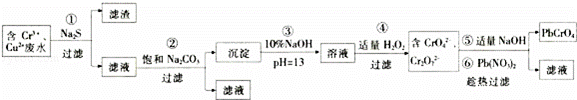
已知:a.该厂的废水中主要含Cr3+,还有少量Cu2+和其它可溶性杂质;
b.Cr(OH)3不溶于水,具有两性,pH=13时,发生反应:Cr(OH3)+OH﹣=﹣
回答下列问题:
(1)滤渣的成分是 (填化学式);第②步加入Na2CO3溶液的作用是 .
(2)第④步生成CrO42﹣的离子方程式为 .
(3)第⑤步加入NaOH的目的是为了提高铅铬黄的产率,请用化学平衡移动原理加以解释: .
(4)测定铅铬黄纯度:取mg铅铬黄样品溶解,加足量KI将其还原为Cr3+,再用 c mol•L﹣1 Na2S2O3标准液滴定(反应:2Na2S2O3+I2=Na2S4O6+2NaI),消耗体积VmL.该滴定实验中所需主要玻璃仪器有烧杯、 ,测定标准液体积的仪器事先进行洗涤所用试剂依次为 ;此铅铬黄样品的质量分数w=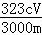 (用含c、m和V的式子表示).
(用含c、m和V的式子表示).
查看答案和解析>>
科目:高中化学 来源: 题型:
已知葡萄糖(C6H12O6)的燃烧热是2804kJ•mol﹣1,当它被氧化生成1mol水时放出的热量是()
A. 26.0kJ B. 5 1.9kJ C. 155.8kJ D. 467.3kJ
1.9kJ C. 155.8kJ D. 467.3kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
在微生物作用下,NH4+经过两步反应被氧化成NO3﹣.反应的能量变化示意图如下:
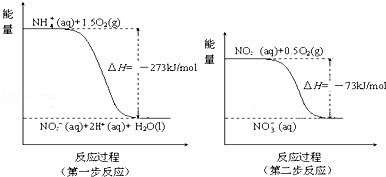
①第一步反应是 反应(选填“放热”或“吸热”),判断依据是 .
②1mol NH4+(aq)全部氧化成NO3﹣(aq)的热化学方程式是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com