
| A. | 属于分子晶体 | B. | [PCl4]+空间构型为正四面体 | ||
| C. | 阴阳离子均含有配位键 | D. | 固态可导电 |
分析 PCl5•AlCl3由[PCl4]+和[AlCl4]-构成,属于离子化合物,固态时没有自由移动的离子,不能导电,[PCl4]+中没有配位键,离子中P原子孤电子对数为$\frac{5-1-1×4}{2}$=0,价层电子对数为4+0=4,为正四面体构型.
解答 解:A.PCl5•AlCl3由[PCl4]+和[AlCl4]-构成,属于离子晶体,故A错误;
B.[PCl4]+离子中P原子孤电子对数为$\frac{5-1-1×4}{2}$=0,价层电子对数为4+0=4,为正四面体构型,故B正确;
C.[AlCl4]-中Al有空轨道,存在配位键,[PCl4]+中P没有空轨道,没有配位键,故C错误;
D.PCl5•AlCl3属于离子晶体,固态时没有自由移动的离子,不能导电,故D错误,
故选:B.
点评 本题考查晶体类型与性质、微粒空间结构判断、配位键,注意中心原子有空轨道、配体有孤对电子,可以形成配位键.


科目:高中化学 来源: 题型:解答题
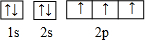 .
.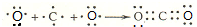 ,1molce2含有σ键的数目为6.02×1023.
,1molce2含有σ键的数目为6.02×1023.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HBr、HCl、AgCl | B. | CaCO3、CH3COONa、NaHSO4 | ||
| C. | HClO、HF、NH3 | D. | H2CO3、CH3COOH、H2S |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Zn的电子排布式:1s22s22p63s23p64s2 | |
| B. | Fe2+的原子结构示意图: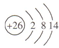 | |
| C. | C的价电子轨道表示式: | |
| D. | HClO的电子式: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可向海水中加入明矾使海水淡化从而解决淡水供应危机 | |
| B. | 福尔马林可用于浸制标本,是因为其能使蛋白质变性 | |
| C. | 医用酒精通常是指体积分数为75%的乙醇溶液 | |
| D. | 向烟花中添加含钠、钙、铜等金属元素的化合物可在燃放时产生绚丽缤纷的效果 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
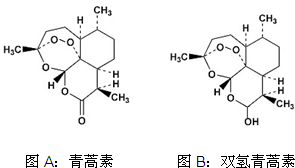 中国女药学家屠呦呦因创制新型抗疟药青蒿素和双氢青蒿素而获得2015年诺贝尔生理学或医学奖.下列有关青蒿素和双氢青蒿素(结构分别为图A、图B)的说法中不正确的是( )
中国女药学家屠呦呦因创制新型抗疟药青蒿素和双氢青蒿素而获得2015年诺贝尔生理学或医学奖.下列有关青蒿素和双氢青蒿素(结构分别为图A、图B)的说法中不正确的是( )| A. | 青蒿素的分子式为C15H22O5 | |
| B. | 由青蒿素制备双氢青蒿素的反应属还原反应 | |
| C. | 青蒿素分子中含有过氧键和酯基、醚键 | |
| D. | 双氢青蒿素分子中有2个六元环和2个七元环 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com