
| A. | 往淡水中加入NaCl等配成人造海水,可用于海产品的长途运输 | |
| B. | 氢氧化镁分解时吸收大量热量,可添加到合成树脂中做阻燃剂 | |
| C. | 酒精能使蛋白质变性,无水酒精在医学上常被用于消毒 | |
| D. | 利用粮食酿酒经过了淀粉→葡萄糖→乙醇的化学变化过程 |
分析 A.淡水中加入NaCl等配成人造海水,提供海产品能生存的环境;
B.根据灭火的原理,以及氢氧化镁在380℃时,分解放出水蒸气和耐高温的固体氧化镁这一性质回答.分解过程中吸收大量的热,水蒸气能稀释氧气,氧化镁固体能隔绝氧气或空气;
C.医用酒精体积分数为75%;
D.淀粉→葡萄糖→乙醇都是化学变化.
解答 解:A.淡水中加入NaCl等配成人造海水,提供海产品能生存的环境,提高海产品的存活率,便于长途运输,故A正确;
B.阻燃物质原理有三个:清除可燃物、隔绝氧气或空气、使可燃物的温度降到着火点以下,三者具其一即可,氢氧化镁在380℃时分解,方程式为:Mg(OH)2MgO+H2O↑.氢氧化镁分解过程中吸收大量的热,能使可燃物的温度降到着火点以下,反应生成的水蒸气能稀释可燃物表面的氧气,生成氧化镁固体能隔绝氧气或空气,故B正确;
C.医用酒精为75%乙醇溶液,在医学上常被用于消毒,故C错误;
D.用粮食酿酒时,先在糖化酶作用下水解为葡萄糖,然后在酵母作用下转变为酒精,都是化学变化,故D正确;
故选C.
点评 本题考查了化学知识的应用,涉及氢氧化镁的性质、乙醇的性质、粮食酿酒的过程等,掌握基础是学习的关键,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
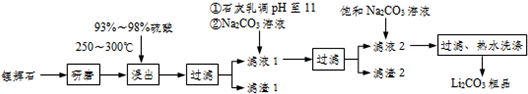
| T/℃ | 20 | 40 | 60 | 80 |
| S(Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 |
| S(Li2CO4)/g | 34.2 | 32.8 | 31.9 | 30.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  点燃酒精灯 | |
| B. | 不慎将浓碱溶液沾到皮肤上,要立即用大量水冲洗,然后涂上2%~5%的硼酸溶液 | |
| C. |  制备氢气并检验H2的可燃性 | |
| D. | 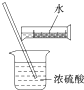 配制硫酸溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
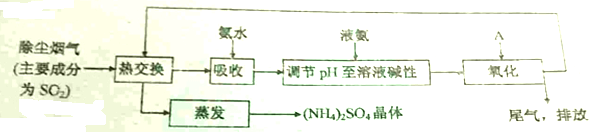
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 已知溶液 | 大量存在的离子 |
| A | NH4HCO3溶液 | K+、Na+、NO3-、Cl- |
| B | FeCl3溶液 | Fe2+、NH4+、SCN-、SO42- |
| C | 中性溶液 | Cu2+、K+、Cl-、SO42- |
| D | CH3COOH溶液 | NH4+、Na+、SO42-、CO32- |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 难溶电解质 | Mg(OH)2 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 溶解度/g | 9×10-4 | 1.7×10-6 | 1.5×10-4 | 3.0×10-9 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| t/s | 0 | 50 | 150 | 250 | 350 |
| N(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
| A. | T℃时,该反应的平衡常数K=0.05mol•L-1 | |
| B. | 0-50s内反应的平均反应速率v(Cl2)=0.0032mol•L-1•s-1 | |
| C. | 其他条件不变,升高温度,平衡时c(PCl3)=0.12mol•L-1,则该反应的△H<0 | |
| D. | T℃时,若起始充入1.0molPCl5、0.2molPCl3和0.2molCl2,则起始时v(正)>v(逆) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com