
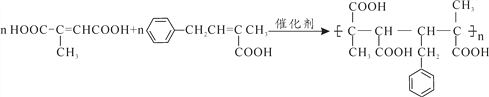
”¾ĢāÄæ”æ¾ŪŗĻ·“Ó¦ŹĒÖʱøŠĀŠĶ²ÄĮĻµÄÖŲŅŖĶ¾¾¶”£ÓÉĢģČ»Ļš½ŗµÄµ„ĢåAÖʱøµÄ»ÆŗĻĪļF”¢K·¢Éś¼Ó¾Ū·“Ó¦æɵƵ½ŠĀŠĶøß·Ö×Ó²ÄĮĻ”£

ŅŃÖŖ£ŗ¢ŁEµÄ½į¹¹¼ņŹ½ĪŖ £¬ŗģĶā¹āĘ׷زāµĆF”¢K·Ö×Ó¾łŗ¬ÓŠ¼×»ł”£
£¬ŗģĶā¹āĘ׷زāµĆF”¢K·Ö×Ó¾łŗ¬ÓŠ¼×»ł”£
¢Ś![]()
£Ø1£©A°“ĻµĶ³ĆüĆū·ØµÄĆū³ĘĪŖ_____________________”£
£Ø2£©·“Ó¦¢ŁµÄ·“Ó¦ĄąŠĶĪŖ________________£¬Éč¼Ę²½Öč¢Ł¢ŪÄæµÄŹĒ______________”£
£Ø3£©ÓŠ»śĪļ¼×µÄ½į¹¹¼ņŹ½ĪŖ_______________”£
£Ø4£©Š“³öFÓėK°“ĪļÖŹµÄĮæ1:1¹²¾ŪŠĪ³Éøß·Ö×Ó»ÆŗĻĪļµÄ»Æѧ·½³ĢŹ½ĪŖ______________________________”£
£Ø5£©ÓŠ»śĪļŅŅŹĒJµÄĶ¬ĻµĪļ£¬ĒŅ±ČJÉŁŅ»øöĢ¼Ō×Ó£¬ŅŅÓŠ¶ąÖÖĶ¬·ÖŅģ¹¹Ģ壬ĘäÖŠÄÜĀś×ćĻĀĮŠĢõ¼žµÄĶ¬·ÖŅģ¹¹ĢåÓŠ_________ÖÖ”£
a£®ŗ¬ÓŠ·ÓōĒ»ł
b£®ÄÜ·¢ÉśĖ®½ā·“Ó¦ĒŅÄÜ·¢ÉśŅų¾µ·“Ó¦
c£®±½»·ÉĻµÄŅ»ĀČ“śĪļÖ»ÓŠŅ»ÖÖ
d£®ŗĖ“Ź²ÕńĒāĘ×ÓŠ5×é·å
£Ø6£©²ĪÕÕÉĻŹöŗĻ³ÉĀ·Ļߣ¬Éč¼ĘŅ»ĢõÓÉŅŅ¶ž“¼ŗĶ±½ĪŖŌĮĻ£ØĪŽ»śŹŌ¼ĮČĪŃ”£©Öʱø±½ŅŅĖį £Ø![]() £©µÄŗĻ³ÉĀ·Ļß_________”£
£©µÄŗĻ³ÉĀ·Ļß_________”£
”¾“š°ø”æ 2-¼×»ł-1,3-¶”¶žĻ© ¼Ó³É·“Ó¦ ±£»¤Ģ¼Ģ¼Ė«¼ü²»±»Ńõ»Æ ![]()
 2
2 ![]()
![]()
”¾½āĪö”æA£ŗ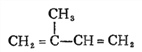 Óėäå·¢Éś1£¬4-¼Ó³ÉÉś³ÉB£ŗ
Óėäå·¢Éś1£¬4-¼Ó³ÉÉś³ÉB£ŗ £»
£» ŌŚĒāŃõ»ÆÄĘĖ®ČÜŅŗÖŠ¼ÓČČĖ®½ā²śÉśC£ŗ
ŌŚĒāŃõ»ÆÄĘĖ®ČÜŅŗÖŠ¼ÓČČĖ®½ā²śÉśC£ŗ £»
£» ÓėĖłĀČ»ÆĒā·¢Éś¼Ó³É·“Ӧɜ³ÉD£ŗ
ÓėĖłĀČ»ÆĒā·¢Éś¼Ó³É·“Ӧɜ³ÉD£ŗ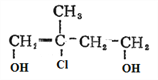 £»
£»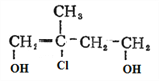 ±»ĖįŠŌøßĆĢĖį¼ŲŃõ»ÆÉś³ÉE£ŗ
±»ĖįŠŌøßĆĢĖį¼ŲŃõ»ÆÉś³ÉE£ŗ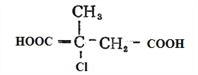 £»
£» ŌŚĒāŃõ»ÆÄĘĖ®ČÜŅŗÖŠ¼ÓČČĖ®½āŗó£¬ŌŁĖį»ÆµĆµ½G£ŗ
ŌŚĒāŃõ»ÆÄĘĖ®ČÜŅŗÖŠ¼ÓČČĖ®½āŗó£¬ŌŁĖį»ÆµĆµ½G£ŗ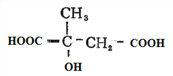 £»ŌŚĒāŃõ»ÆÄʵÄŅŅ“¼ČÜŅŗÖŠ¼ÓČČĻūČ„·“Ó¦ŗóŌŁĖį»ÆµĆµ½F£ŗ
£»ŌŚĒāŃõ»ÆÄʵÄŅŅ“¼ČÜŅŗÖŠ¼ÓČČĻūČ„·“Ó¦ŗóŌŁĖį»ÆµĆµ½F£ŗ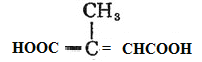 £»
£»
£Ø1£©ĢģČ»Ļš½ŗµÄµ„ĢåŹĒŅģĪģ¶žĻ©£ŗ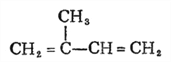 °“ĻµĶ³ĆüĆū·ØµÄĆū³ĘĪŖ£ŗ2-¼×»ł-1,3-¶”¶žĻ©£»£Ø2£©·“Ó¦¢ŁĪŖ¼Ó³É·“Ó¦£¬¢Łµ½¢Ū·“Ó¦Ē°ŗó²»±äµÄĪŖĢ¼Ģ¼Ė«¼ü£¬¹ż³ĢÖŠ·¢ÉśŃõ»Æ·“Ó¦£¬ŌņæĻ¶ØĪŖ±£»¤Ģ¼Ģ¼Ė«¼ü²»±»Ńõ»Æ£»£Ø3£©H£Ø
°“ĻµĶ³ĆüĆū·ØµÄĆū³ĘĪŖ£ŗ2-¼×»ł-1,3-¶”¶žĻ©£»£Ø2£©·“Ó¦¢ŁĪŖ¼Ó³É·“Ó¦£¬¢Łµ½¢Ū·“Ó¦Ē°ŗó²»±äµÄĪŖĢ¼Ģ¼Ė«¼ü£¬¹ż³ĢÖŠ·¢ÉśŃõ»Æ·“Ó¦£¬ŌņæĻ¶ØĪŖ±£»¤Ģ¼Ģ¼Ė«¼ü²»±»Ńõ»Æ£»£Ø3£©H£Ø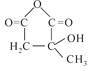 £©×Ŗ»ÆĪŖIÓėŅŃÖŖ¢ŚĻąĖĘ£ŗ
£©×Ŗ»ÆĪŖIÓėŅŃÖŖ¢ŚĻąĖĘ£ŗ![]() £»HæŖ»·ŗóÉś³ÉµÄIŌö¼Ó6øöĢ¼£¬¶ųŹŌ¼Į¼×±ŲŠėŗ¬±½»·ĒŅÖ»ÓŠ6øöĢ¼£¬ŌņÓŠ»śĪļ¼×µÄ½į¹¹¼ņŹ½ĪŖ£ŗ
£»HæŖ»·ŗóÉś³ÉµÄIŌö¼Ó6øöĢ¼£¬¶ųŹŌ¼Į¼×±ŲŠėŗ¬±½»·ĒŅÖ»ÓŠ6øöĢ¼£¬ŌņÓŠ»śĪļ¼×µÄ½į¹¹¼ņŹ½ĪŖ£ŗ![]() £»
£»
£Ø4£©FŹĒ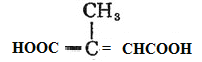 ”¢KÄÜ·¢Éś¼Ó¾Ū·“Ó¦ĒŅŗ¬ÓŠÓŠ¼×»ł£¬ŌņKĪŖ£ŗ
”¢KÄÜ·¢Éś¼Ó¾Ū·“Ó¦ĒŅŗ¬ÓŠÓŠ¼×»ł£¬ŌņKĪŖ£ŗ![]() £¬ FÓėK°“ĪļÖŹµÄĮæ1:1¹²¾ŪŠĪ³Éøß·Ö×Ó»ÆŗĻĪļµÄ»Æѧ·½³ĢŹ½ĪŖ£ŗ
£¬ FÓėK°“ĪļÖŹµÄĮæ1:1¹²¾ŪŠĪ³Éøß·Ö×Ó»ÆŗĻĪļµÄ»Æѧ·½³ĢŹ½ĪŖ£ŗ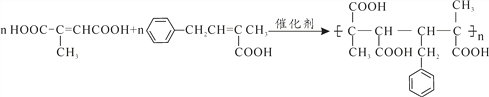 £»
£»
£Ø5£©ÓŠ»śĪļŅŅŹĒJµÄĶ¬ĻµĪļ£¬ĒŅ±ČJÉŁŅ»øöĢ¼Ō×Ó£¬
a£®ŗ¬ÓŠ·ÓōĒ»ł£¬ōĒ»łÖ±½ÓĮ¬ŌŚ±½»·ÉĻ£¬b£®ÄÜ·¢ÉśĖ®½ā·“Ó¦ĒŅÄÜ·¢ÉśŅų¾µ·“Ó¦£¬¾ßÓŠ¼×Ėįõ„µÄ½į¹¹£¬c£®±½»·ÉĻµÄŅ»ĀČ“śĪļÖ»ÓŠŅ»ÖÖ£¬æÉÄÜÖ»ÓŠĮ½øö¶Ō³ĘµÄČ”“śĪ»£¬d£®ŗĖ“Ź²ÕńĒāĘ×ÓŠ5×é·åŌņĀś×ćĢõ¼žµÄŅŅµÄĶ¬·ÖŅģ¹¹ĢåÓŠ£ŗ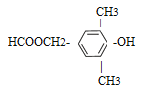 ”¢
”¢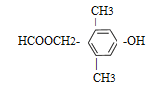 2ÖÖ£»£Ø6£©ŅŅ¶ž“¼ŌŚĖįŠŌøßĆĢĖį¼ŲČÜŅŗÖŠ±»Ńõ»ÆÉś³ÉŅŅ¶žĖį£¬ŅŅ¶žĖįŌŚŅ»¶ØĢõ¼žĻĀ×Ŗ»ÆĪŖ
2ÖÖ£»£Ø6£©ŅŅ¶ž“¼ŌŚĖįŠŌøßĆĢĖį¼ŲČÜŅŗÖŠ±»Ńõ»ÆÉś³ÉŅŅ¶žĖį£¬ŅŅ¶žĖįŌŚŅ»¶ØĢõ¼žĻĀ×Ŗ»ÆĪŖ![]() £¬
£¬![]() Óė±½ŌŚ“߻ƼĮ×÷ÓĆĻĀ×Ŗ»ÆĪŖ
Óė±½ŌŚ“߻ƼĮ×÷ÓĆĻĀ×Ŗ»ÆĪŖ![]() £¬
£¬![]() ŌŚŅ»¶ØĢõ¼žĻĀ×Ŗ»ÆĪŖ
ŌŚŅ»¶ØĢõ¼žĻĀ×Ŗ»ÆĪŖ![]() £¬¹ŹŗĻ³ÉĀ·ĻßĪŖ
£¬¹ŹŗĻ³ÉĀ·ĻßĪŖ![]()
![]() ӣ
ӣ



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æÄ³Ń§Ļ°Š”×éŌŚŹµŃéŹŅÖŠĄūÓĆĻĀĶ¼×°ÖĆ(¼Š³Ö×°ÖĆĀŌČ„)²ā¶ØijĢśĮņ»ÆĪļ(FexSy)µÄ×é³É£¬²¢Ģ½¾æ·“Ó¦ŗóD×°ÖĆĖłµĆČÜŅŗÖŠŗ¬Įņ»ÆŗĻĪļµÄ×é³É”£

(Ņ»)Įņ»ÆĪļ(FexSy)µÄ×é³É
ŹµŃé²½Öč£ŗ
²½Öč¢ń ČēĶ¼Į¬½Ó×°ÖĆ£¬¼ģĖ×°ÖĆĘųĆÜŠŌ£¬×°ČėŅ©Ę·£»
²½Öč¢ņ “ņæŖ·ÖŅŗĀ©¶·ŠżČū£¬»ŗ»ŗµĪČėĖ®£¬²¢µćČ¼¾Ę¾«ÅēµĘ£»
²½Öč¢ó µ±Ó²ÖŹ²£Į§¹ÜÖŠ¹ĢĢåÖŹĮæ²»ŌŁøı䏱£¬Ķ£Ö¹¼ÓČČ£¬¼ĢŠųĶØČė”Ŗ¶ĪŹ±¼äµÄO2
²½Öč¢ō ŹµŃé½įŹųŗ󣬽«DÖŠĖłµĆČÜŅŗ¼ÓĖ®ÅäÖĘ³É250 mLČÜŅŗ£»
””
Ēė»Ų“š£ŗ
¢ÅŅĒĘ÷aµÄ×÷ÓĆĪŖ______________________”£
(2)²½Öč¢óÖŠ£¬Ķ£Ö¹¼ÓČČŗ󻹊č¼ĢŠųĶØČėŅ»¶ĪŹ±¼äµÄO2£¬ĘäÄæµÄĪŖ__________________”£
(3)²½ÖčIVÖŠÅäÖĘČÜŅŗŹ±ĖłŠčµÄ²£Į§ŅĒĘ÷³ż²£Į§°ōŗĶÉÕ±Ķā£¬»¹ÓŠ___________________”£
(4)Č”25. 00 mL²½ÖčIVÖŠĖłÅäČÜŅŗ£¬¼ÓČė×ćĮæµÄĖ«ŃõĖ®£¬ŌŁ¼ÓČė×ćĮæŃĪĖįĖį»ÆµÄBaCl2ČÜŅŗ£¬½«ĖłµĆ³Įµķ¹żĀĖ”¢Ļ“µÓ”¢øÉŌļ£¬³ĘĘäÖŹĮæĪŖ4.66g”£ŌņFexSyµÄ»ÆѧŹ½ĪŖ___________________”£
(5)ĪŹĢāĢÖĀŪ£ŗÓŠĶ¬Ń§ČĻĪŖæɽ«×°ÖĆDøÄĪŖ×°ÓŠ×ćĮæ¼īŹÆ»ŅµÄøÉŌļ¹Ü£¬Ķعż²ā¶Ø·“Ó¦Ē°ŗóøÉŌļ¹ÜµÄŌöÖŲĄ“¼ĘĖćĮņŌŖĖŲµÄŗ¬Į攣ÄćČĻĪŖ“Ė·½°ø________(Ģī”°ŹĒ”±»ņ”°·ń”±)ŗĻĄķ£¬ŌŅņĪŖ_______________________”£
(¶ž)Ģ½¾æ·“Ó¦ŗóD×°ÖĆĖłµĆČÜŅŗÖŠŗ¬Įņ»ÆŗĻĪļµÄ×é³É”£
ĄķĀŪĶĘ²ā£ŗČÜŅŗÖŠ³żŗ¬ÓŠNa2SO4Ķā£¬»¹æÉÄÜŗ¬ÓŠNa2SO3”£
ŹµŃéĢ½¾æ£ŗµĪ¶Ø·Ø²ā¶ØČÜŅŗÖŠNa2SO3µÄŗ¬Į攣
æɹ©Ń”ŌńµÄŹŌ¼Į£ŗ¢Ł0.10 mol L-1 KmnO4ĖįŠŌČÜŅŗ ¢Ś30%H2O2
¢Ū0.10 mol L-1 KIµķ·ŪČÜŅŗ
(6)ĖłŃ”ŹŌ¼ĮĪŖ___________(ĢīŠņŗÅ)£»ĖłŃ”ŹŌ¼ĮӦװŌŚ_____________(Ģī”°ĖįŹ½”±»ņ”°¼īŹ½”±)µĪ¶Ø¹ÜÖŠ”£
¢ßĖłĄūÓƵķ“Ó¦ŌĄķĪŖ__________________(ÓĆĄė×Ó·½³ĢŹ½±ķŹ¾)”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĮ½øöČŻ»ż¾łĪŖ10LµÄĆܱÕČŻĘ÷¢ńŗĶ¢ņÖŠ·¢Éś·“Ó¦£ŗ2NO(g)+2CO(g) ![]() N2(g)+2CO2(g)£¬ĘšŹ¼ĪļÖŹµÄĮæ¼ūĻĀ±ķ”£ŹµŃé²āµĆĮ½ČŻĘ÷²»Ķ¬ĪĀ¶ČĻĀ“ļµ½Ę½ŗāŹ±CO2µÄĪļÖŹµÄĮæÅضČČēĻĀĶ¼ĖłŹ¾£¬ĻĀĮŠĖµ·Ø“ķĪóµÄŹĒ
N2(g)+2CO2(g)£¬ĘšŹ¼ĪļÖŹµÄĮæ¼ūĻĀ±ķ”£ŹµŃé²āµĆĮ½ČŻĘ÷²»Ķ¬ĪĀ¶ČĻĀ“ļµ½Ę½ŗāŹ±CO2µÄĪļÖŹµÄĮæÅضČČēĻĀĶ¼ĖłŹ¾£¬ĻĀĮŠĖµ·Ø“ķĪóµÄŹĒ

ČŻĘ÷ | ĘšŹ¼ĪļÖŹµÄĮæ | ||
NO | CO | ||
¢ń | 1mol | 0.5mol | |
¢ņ | 2mol | 1mol | |
A. ·“Ó¦N2(g)+2CO2(g)![]() 2NO(g)+2CO(g)µÄ¦¤H£¼0£¬¦¤S£¾0
2NO(g)+2CO(g)µÄ¦¤H£¼0£¬¦¤S£¾0
B. PµćµÄĖŁĀŹ±ČMµćĀż
C. M”¢NĮ½µćČŻĘ÷ÄŚµÄŃ¹Ēæ£ŗ P(M) £¼2P(N)
D. NµćµÄĘ½ŗā³£ŹżĪŖ44.4
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ
H”¢C”¢N”¢O”¢W”¢Fe”¢V¶¼ŹĒÉś»īÓė»Æѧ¹¤ŅµÖŠ³£¼ūŌŖĖŲ£¬Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ
¢ÅĢ¼øŗĄė×ÓCH3-µÄæռ乹ŠĶĪŖ_______£»øł¾ŻµČµē×ÓŌĄķ£¬NO+µÄµē×ÓŹ½ĪŖ________”£
¢ĘN”¢Na+”¢Fe3+”¢Cu2+ĖÄÖÖĪ¢Į£»łĢ¬µÄŗĖĶāµē×ÓÅŲ¼Ź½ÖŠĪ“³É¶Ōµē×ÓŹż×ī¶ąµÄŹĒ________£»Cu2+ŌŚĖ®ÖŠ³ŹĻÖĄ¶É«ŹĒŅņĪŖŠĪ³ÉĮĖĖ®ŗĻĶĄė×Ó£¬Ęä»ÆѧŹ½ĪŖ______”£

(3)·°æÉÓĆÓŚČĖ¹¤ŗĻ³ÉµÄ¶ž¼Ū·°¹ĢµŖĆĄĆø(½į¹¹ČēĶ¼¼×)”£·°¹ĢµŖĆøÖŠ·°µÄÅäĪ»Ō×ÓÓŠ__________(ĢīŌŖĖŲ·ūŗÅ)”£
(4)ŃĢõ£°·(½į¹¹ČēĶ¼ŅŅ)æÉÓĆÓŚŗĻ³É¹āŗĻøØĆøNADPH£¬ŃĢõ£°··Ö×ÓÖŠµŖŌ×ÓµÄŌӻƹģµĄĄąŠĶÓŠ______£¬1 moløĆ·Ö×ÓÖŠŗ¬¦Ņ¼üµÄŹżÄæĪŖ________________”£
(5)ĻĀĶ¼ĪŖĢ¼»ÆĪŁ¾§ĢåµÄŅ»²æ·Ö½į¹¹£¬Ģ¼Ō×ÓĒ¶Čė½šŹōĪŁµÄ¾§øńµÄ¼äĻ¶£¬²¢²»ĘĘ»µŌÓŠ½šŹōµÄ¾§øń£¬ŠĪ³ÉĢīĻ¶+¹ĢČÜĢ壬Ņ²³ĘĪŖĢīĻ¶»ÆŗĻĪļ”£ŌŚ“Ė½į¹¹ÖŠ£¬ĘäÖŠĪŁŌ×ÓÓŠ______øö£¬1øöĪŁŌ×ÓÖÜĪ§¾ąĄėĪŁŌ×Ó×ī½üµÄĢ¼Ō×ÓÓŠ______øö£¬¼ŁÉčøĆ²æ·Ö¾§ĢåµÄĢå»żĪŖVcm3£¬Ģ¼»ÆĪŁµÄĦ¶ūÖŹĮæĪŖM g/mol£¬ĆܶČĪŖb g/cm3£¬Ōņ°¢·ü¼ÓµĀĀŽ³£ŹżNAÓĆÉĻŹöŹż¾ŻæÉŅŌ±ķŹ¾ĪŖ___________________”£
(6)12 gŹÆÄ«Ļ©(½į¹¹ČēĶ¼±ū)ÖŠŗ¬ÓŠµÄÕżĮł±ßŠĪµÄĪļÖŹµÄĮæĪŖ_____mol£»ĒėÄćŌ¤²ā¹čŹĒ·ńČŻŅ׊Ī³ÉĄąĖĘŹÆÄ«Ļ©µÄ½į¹¹£¬²¢ĖµĆ÷ĄķÓÉ____________________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æÓŠ¹Ų100mL 0.1mol/L K2SO4ČÜŅŗµÄŠšŹöÕżČ·µÄŹĒ
A. ŗ¬ÓŠ0.1molK2SO4 B. Ė®µÄĢå»żĪŖ0.1L
C. c(K+)=0.2 mol/L D. Č”³ö10mLČÜŅŗ£¬c(K2SO4)=0.01mol/L
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŃĒĀČĖįÄĘ(NaClO2)ŌŚČÜŅŗÖŠ¶ŌÉś³ÉClO2”¢HClO2”¢ClO2-”¢Cl-µČ£¬ĘäÖŠHClO2ŗĶClO2¶¼ŹĒ¾ßÓŠĘÆ°××÷ÓĆ”£ŅŃÖŖpOH=©lgc(OH-)£¬¾²ā¶Ø25”ꏱø÷×é·Öŗ¬ĮæĖępOH±ä»ÆĒéæöČēĶ¼ĖłŹ¾(Cl-ƻӊ»³ö)£¬“ĖĪĀ¶ČĻĀ£¬ĻĀĮŠ·ÖĪöÕżČ·µÄŹĒ

A. HClO2µÄµēĄėĘ½ŗā³£ŹżµÄŹżÖµKa=10-8
B. pOH=11Ź±£¬ClO2-²æ·Ö×Ŗ»Æ³ÉClO2ŗĶCl-Ąė×ӵķ½³ĢŹ½ĪŖ£ŗ5ClO2-+2H2O=4ClO2+ Cl-+4OH-
C. pH=7Ź±£¬ČÜŅŗÖŠŗ¬ĀČĪ¢Į£µÄÅØ¶Č“óŠ”ĪŖ£ŗc(HClO2)£¾c(ClO2-)£¾c(ClO2)£¾c(Cl-)
D. Ķ¬ÅØ¶ČµÄHClO2ČÜŅŗŗĶNaClO2ČÜŅŗµČĢå»ż»ģŗĻ£¬Ōņ»ģŗĻČÜŅŗÖŠÓŠc(HClO2)+2c(H+)=c(ClO2-)+2c(OH-)
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŅŃÖŖŌŖĖŲSeĪ»ÓŚµŚĖÄÖÜĘŚ¢öA×壬ĻĀĮŠĖµ·Ø²»ÕżČ·µÄŹĒ
A. SeµÄŌ×ÓŠņŹżĪŖ34
B. µ„ÖŹSeŌŚæÕĘųÖŠČ¼ÉÕæÉÉś³ÉSeO3
C. æÉŠĪ³ÉNa2SeO3”¢Na2SeO4Į½ÖÖŃĪ
D. H2S±ČH2SeĪȶØ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻū³żµŖŃõ»ÆĪļ”¢¶žŃõ»ÆĮņµČĪļÖŹŌģ³ÉµÄĪŪČ¾ŹĒÄæĒ°ŃŠ¾æµÄÖŲŅŖæĪĢā”£
£Ø1£©Č¼ĆŗŃĢĘųĶŃĮņ³£ÓĆČēĻĀ·½·Ø”£
¢ŁÓĆÉśĪļÖŹČČ½āĘų(Ö÷ŅŖ³É·ÖCO”¢CH4”¢H2)½«SO2ŌŚøßĪĀĻĀ»¹Ō³Éµ„ÖŹĮņ”£Éę¼°µÄ²æ·Ö·“Ó¦ČēĻĀ£ŗ2CO(g)+SO2(g)=S(g)+2CO2(g) ”÷H1= + 8.0 kJ”¤mol-1
2CO(g)+O2(g)=2CO2(g) ”÷H2=£566.0kJ”¤mol-1
2H2(g)+O2(g)=2H2O(g) ”÷H3=£483.6 kJ”¤mol-1
ŌņH2(g)»¹ŌSO2(g)Éś³ÉS(g)ŗĶH2O(g)µÄČČ»Æѧ·½³ĢŹ½ĪŖ______________________”£
¢ŚŅ»Ńõ»ÆĢ¼»¹Ō·Ø£ŗŌŚ¾ųČČŗćČŻµÄĆܱÕČŻĘ÷ÖŠ£¬·“Ó¦2CO(g)+SO2(g)![]() S(s)+2CO2(g)“ļµ½Ę½ŗāŹ±£¬ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ____(ĢīŠņŗÅ)”£
S(s)+2CO2(g)“ļµ½Ę½ŗāŹ±£¬ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ____(ĢīŠņŗÅ)”£
a£®ČŻĘ÷ÄŚĘųĢåµÄŃ¹Ēæ±£³Ö²»±ä b£®·ÖĄė³öS£¬Õż·“Ó¦ĖŁĀŹ¼õŠ”
ČōŌŁ³äČėŅ»¶ØĮæµÄCO2£¬·“Ó¦µÄĘ½ŗā³£Źż²»±ä
¢ŪÓĆ°±Ė®½«SO2×Ŗ»ÆĪŖNH4HSO3£¬ŌŁŃõ»Æ³É(NH4)2SO4”£ŹµŃé²āµĆNH4HSO3ČÜŅŗÖŠ![]() =15£¬ŌņČÜŅŗµÄpHĪŖ________”£ (ŅŃÖŖ£ŗH2SO3µÄKa1=1.5”Į10-2£¬Ka2=1.0”Į10-7)
=15£¬ŌņČÜŅŗµÄpHĪŖ________”£ (ŅŃÖŖ£ŗH2SO3µÄKa1=1.5”Į10-2£¬Ka2=1.0”Į10-7)
£Ø2£©µē½āNOæÉŅŌÖʱøNH4NO3,Ę乤×÷ŌĄķČēĻĀĶ¼ĖłŹ¾£¬Ńō¼«µÄµē¼«·“Ó¦Ź½ĪŖ£ŗ____________£¬ĪŖŹ¹µē½ā²śĪļČ«²æ×Ŗ»ÆĪŖNH4NO3£¬Šč²¹³äĪļÖŹA£¬AŹĒ___________ ”£

£Ø3£©Na2SŹĒ³£ÓĆµÄ³Įµķ¼Į”£Ä³¹¤ŅµĪŪĖ®ÖŠŗ¬ÓŠµČÅØ¶ČµÄCu2+”¢Fe2+”¢Pb2+£¬µĪ¼ÓNa2SČÜŅŗŗóŹ×ĻČĪö³öµÄ³ĮµķŹĒ________”£µ±×īŗóŅ»ÖÖĄė×Ó³ĮµķĶźČ«Ź±(øĆĄė×ÓÅضČĪŖ10-5 mol”¤L-1),“ĖŹ±S2-µÄÅضČĪŖ_________________________
£ØŅŃÖŖ: Ksp(FeS)=6.3”Į10-18 £»Ksp(CuS)=6”Į10-36 £»Ksp(PbS)=2.4”Į10-28£©
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠĖµ·ØÕżČ·µÄŹĒ
A. ·Šµć£ŗĮŚ¶ž¼×±½>¼ä¶ž¼×±½>¶Ō¶ž¼×±½
B. ¼¦µ°[ŌŚNH4ClČÜŅŗÖŠÄÜ·¢ÉśŃĪĪö£¬µ«ŹĒ²»ÄÜŗĶŃĪĖį·¢Éś»Æѧ·“Ó¦
C.  ÓŠ»śĪļAµÄ·Ö×ÓŹ½ĪŖC16H16O3
ÓŠ»śĪļAµÄ·Ö×ÓŹ½ĪŖC16H16O3
D.  µĪČėĖįŠŌKMnO4ČÜŅŗÕńµ“£¬×ĻÉ«ĶŹČ„£¬ÄÜÖ¤Ć÷Ęä½į¹¹ÖŠ“ęŌŚĢ¼Ģ¼Ė«¼ü
µĪČėĖįŠŌKMnO4ČÜŅŗÕńµ“£¬×ĻÉ«ĶŹČ„£¬ÄÜÖ¤Ć÷Ęä½į¹¹ÖŠ“ęŌŚĢ¼Ģ¼Ė«¼ü
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com