
【题目】汽车尾气中NOx的生成和消除是科学家研究的重要课题。
(1)NOx能形成酸雨,NO2转化为HNO3的化学方程式是__。
(2)汽车发动机工作时会引发N2(g)+O2(g)=2NO(g) H=+180kJ·mol-1,其能量变化示意图如下:
![]()
则NO中氮氧键的键能是__kJ·mol-1。
(3)用NH3可消除NO污染,反应原理为:4NH3+6NO![]() 5N2+6H2O,以n(NH3):n(NO)分别为4:1、3:1、1:3投料,得到NO脱除率随温度变化的曲线如图所示:
5N2+6H2O,以n(NH3):n(NO)分别为4:1、3:1、1:3投料,得到NO脱除率随温度变化的曲线如图所示:
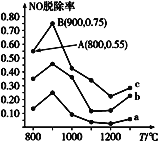
①曲线a对应的n(NH3):n(NO)=__。
②曲线c中NO的起始浓度为4×10-4mg/m3,从A点到B点经过0.8s,该时间段内NO的脱除速率为__mg/(m3·s)。
③由图可知,无论以何种比例反应,在温度超过900℃时NO脱除率都会骤然下降,可能的原因是__(至少写两条)。
【答案】3NO2+H2O=2HNO3+NO或4NO2+O2+2H2O=4HNO3 632 1:3 1×10-4 ⅰ、催化剂的活性下降;ⅱ、氨气可能发生分解;ⅲ、反应为放热反应,温度高反应速率快,达到平衡后平衡逆向移动
【解析】
(1)NO2和水反应生成HNO3和NO。
(2)根据H=反应物化学键断裂吸收的能量-生成物的化学键形成释放的能量,计算氮氧键的键能;
(3)NH3和NO的物质的量的比值越大,NO的脱除率越大,则n(NH3):n(NO)为4:1、3:1、1:3时,对应的曲线为c、b、a。由题给信息,可类比反应速率的定义进行NO的脱出速率的计算。温度升高,NO的脱除率降低,可根据可逆反应的平衡移动进行分析。
(1)NO2与水发生反应:3NO2+H2O=2HNO3+NO或4NO2+O2+2H2O=4HNO3;答案为:3NO2+H2O=2HNO3+NO或4NO2+O2+2H2O=4HNO3;
(2)根据H=反应物化学键断裂吸收的能量-生成物的化学键形成释放的能量,可得:946kJ·mol-1+498 kJ·mol-1-2a kJ·mol-1=180kJ,解得:a=632。答案为:632;
(3)①由分析可知,曲线a对应的n(NH3):n(NO)=1:3;答案为:1:3;
②由图可知,A点到B点,NO的脱除率为0.75-0.55=0.20,则从A点到B点![]() ,则从A点到B点内NO的脱除率为
,则从A点到B点内NO的脱除率为![]() ,答案为:1×10-4;
,答案为:1×10-4;
③可从催化剂、可逆反应的平衡移动、反应物或生成物随温度变化的角度进行分析。在温度超过900℃时NO脱除率都会骤然下降,可能的原因有:ⅰ、催化剂的活性下降;ⅱ、氨气可能发生分解;ⅲ、反应为放热反应,升高温度,达到平衡后平衡逆向移动;答案为:ⅰ、催化剂的活性下降;ⅱ、氨气可能发生分解;ⅲ、反应为放热反应,升高温度,达到平衡后平衡逆向移动。


科目:高中化学 来源: 题型:
【题目】目前世界上60%的镁是从海水中提取的。海水提镁的主要流程如下:
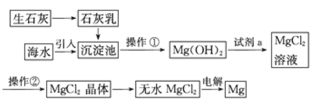
提示:①MgCl2晶体的化学式为MgCl2·6H2O。
②MgO的熔点为2852℃,无水MgCl2的熔点为714℃。
(1)操作①的名称是______,操作②的名称______、_____、过滤。
(2)试剂a的名称是_____。
(3)用氯化镁电解生产金属镁的化学方程式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用MnO2为原料可制取电极材料锰酸锂(LiMnxOy),工业上利用菱锰矿粉(MnCO3)制备MnO2的流程如图:
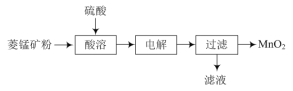
(1)“酸溶”过程中加入过量的硫酸目的是___。
(2)写出“电解”反应的离子反应方程式:___。
(3)为测定LiMnxOy中Mn元素的平均化合价(高于+2价),现进行如下实验:
步骤1:取少量LiMnxOy,分成两等份,分别置于两只锥形瓶中;
步骤2:向一只锥形瓶中加入稀硝酸和双氧水,完全反应后,LiMnxOy中Mn元素转化为Mn2+,除去过量的双氧水。调节pH,滴加指示剂,用浓度为0.400mol·L-1的EDTA标准溶液滴定,终点时消耗EDTA标准溶液20.00mL(已知:Mn2+与EDTA反应的化学计量数之比为1∶1);
步骤3:向另一锥形瓶中加入1.340gNa2C2O4和足量硫酸,充分反应后,用0.100mol·L-1KMnO4标准溶液滴定,到达滴定终点时消耗KMnO4标准溶液16.00mL。
步骤3实验过程中物质发生的转化如下,其中C2O42-均转化为CO2:
LiMnxOy![]() Mn2+;MnO
Mn2+;MnO![]()
![]() Mn2+
Mn2+
①步骤3滴定终点时的实验现象是___。
②计算LiMnxOy中Mn元素的平均化合价___(写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应不属于加成反应的是
A.CH2=CH2+HCl![]() CH3CH2ClB.2CH3CH3+5O2
CH3CH2ClB.2CH3CH3+5O2![]() 2CO2+6H2O
2CO2+6H2O
C.CH2=CH2+H2![]() CH3CH3D.CH2=CH2+Br2―→CH2BrCH2Br
CH3CH3D.CH2=CH2+Br2―→CH2BrCH2Br
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】潮湿环境、Cl-、溶解氧是造成青铜器锈蚀的主要环境因素,腐蚀严重的青铜器表面大多存在起催化作用的多孔催化层。图为青铜器发生电化学腐蚀的原理示意图,下列说法正确的是( )

A.腐蚀过程中,青铜基体是正极
B.若有64gCu腐蚀,理论上耗氧体积为22.4L(标准状况)
C.多孔催化层的形成加速了青铜器的腐蚀速率,是因为改变了反应的焓变
D.环境中的Cl-、正负极产物作用生成多孔粉状锈,其离子方程式为:2Cu2++3OH-+Cl-=Cu2(OH)3Cl↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把1molCH4和一定量Cl2组成的混合气体通入量筒中,将此量筒倒立在盛有饱和食盐水的水槽中,放在光亮处,回答下列问题:

(1)片刻后量筒中的现象:①量筒内气体的黄绿色变浅,②量筒内壁上出现_______________,③量筒内________________________________________。
(2)在反应结束后,量筒内的产物最多的是________,空间构型呈正四面体的产物为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A(g)+3B(g) ![]() 2C(g)+2D(g)在四种不同情况下的反应速率分别为
2C(g)+2D(g)在四种不同情况下的反应速率分别为
①v(A)=0.45 mol·L-1·min-1 ②v(B)=0.6 mol·L-1·s-1 ③v(C)=0.4 mol·L-1·s-1 ④v(D)=0.45 mol·L-1·s-1,该反应进行的快慢顺序为
A. ④>③=②>① B. ④<③=②<① C. ①>②>③>④ D. ④>③>②>①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化钛在一定波长光的照射下,可有效降解甲醛、苯等有机物,效果持久,且自身对人体无害。某课题组研究了溶液的酸碱性对TiO2光催化染料R降解反应的影响,结果如图所示。下列判断正确的是( )

A.在0~20min之间,pH=7时R的降解速率为7×10-2mol·L-1·min-1
B.R的起始浓度为1.5×10-4mol·L-1的降解速率大
C.在这三种pH条件下,二氧化钛对pH=2的R溶液催化降解效率最好
D.在0~50 min之间,R的降解百分率pH=2等于pH=7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,常温下是一种橙黄色有恶臭的液体,它的分子结构与H2O2类似,熔点为193K,沸点为411K,遇水很容易水解,产生的气体能使品红褪色,S2Cl2可由干燥氯气通入熔融的硫中制得。下列有关说法正确的是
A. S2Cl2的电子式为![]()
B. 固态时S2Cl2属于原子晶体
C. S2Cl2与NaOH的化学方程式可能为:S2Cl2+6NaOH=2NaCl+Na2SO3+Na2S+3H2O
D. S2Cl2是含有极性键和非极性键的离子化合物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com