
【题目】将固体NH4I置于密闭容器中,在一定温度下发生下列反应:①NH4I(s)![]() NH3(g)+HI(g);②2HI(g)
NH3(g)+HI(g);②2HI(g) ![]() H2(g)+I2(g)达到平衡时,c(H2)=1 mol·L-1,c(HI)=4 mol·L-1,则此温度下反应①的平衡常数为( )
H2(g)+I2(g)达到平衡时,c(H2)=1 mol·L-1,c(HI)=4 mol·L-1,则此温度下反应①的平衡常数为( )
A. 36 B. 24 C. 16 D. 9
科目:高中化学 来源: 题型:
【题目】下列化学用语的书写,正确的是( )
A. 氯原子的结构示意图:![]()
B. 乙烯的结构式:CH2=CH2
C. 氯化镁的电子式:![]()
D. 乙酸的分子式: CH3COOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组欲探究含硫物质的性质及制备。
【探究一】选用下面的装置和药品探究亚硫酸与次氯酸的酸性强弱:
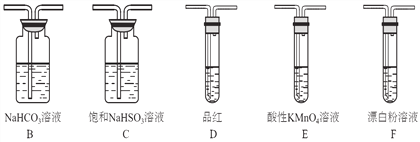
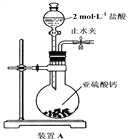
(1)装置A中盛液体的玻璃仪器名称是____________,装置A中反应的化学方程式为________________________________。
(2)装置连接顺序为A、C、_______、_______、D、F,其中装置C的作用是_________,通过现象_________________________________,即可证明亚硫酸的酸性强于次氯酸。
【探究二】连二亚硫酸钠(Na2S2O4)俗称保险粉,广泛用于纺织工业的还原性染色、清洗、印花、脱色以及织物的漂白等。制取保险粉通常需要二氧化硫。
(3)制取Na2S2O4常用甲酸钠法。控制温度70-80℃,在甲醇溶液(溶剂)中溶解甲酸钠(HCOONa),再滴加Na2CO3溶液同时通SO2维持溶液酸性,即可生成Na2S2O4,该反应的离子方程式_________________________________。
(4)测定保险粉纯度。Na2S2O4属于强还原剂,暴露于空气中易被氧气氧化。Na2S2O4遇KMnO4酸性溶液发生反应:5Na2S2O4+6KMnO4+4H2SO4═5Na2SO4+3K2SO4+6MnSO4+4H2O。称取5.0gNa2S2O4样品溶于冷水中,配成100mL溶液,取出10mL该溶液于锥形瓶中,用0.10molL-1的KMnO4溶液滴定。重复上述操作2次,平均消耗KMnO4溶液21.00mL.则该样品中Na2S2O4的质量分数为_______________(杂质不参与反应)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铋(Bi)与氮同族,氯氧化铋(BiOCl)广泛用于彩釉调料、塑料助剂、油漆调色、生产金属铋等。一种用火法炼铜过程产生的铜转炉烟尘(除含铋的化合物之外,还有CuSO4、ZnSO4、CuS、Fe2O3、PbSO4及As2O3)制备高纯氯氧化铋的工艺流程如下:
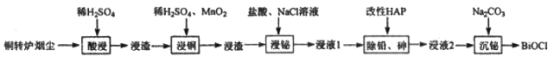
请回答:
(1)Bi位于第六周期,其原子结构示意图为__________________________________。
(2)向“酸浸”所得浸液中加入Zn粉,充分反应后过滤,从溶液中获得ZnSO4·7H2O的操作为__________、过滤、洗涤、干燥。
(3)“浸铜”时,有单质硫生成,其离子方程式为____________________________。
(4)“浸铋”时,温度升高,铋的浸出率降低,其原因为____________________________。
(5)“除铅、砷”时,可以采用以下两种方法。
①加入改性HAP。浸液1与HAP的液固比(L/S)与铅、砷去除率以及后续沉铋量的关系如下表:
L/S | 125:1 | 50:1 | 25:1 | 15:1 |
Pb2+去除率/% | 84.86 | 94.15 | 95.40 | 96.83 |
As3+去除率/% | 98.79 | 98.92 | 98.34 | 99.05 |
m(沉铋)/g | 2.34 | 2.33 | 2.05 | 1.98 |
实验中应采用的L/S=_________________________。
②铁盐氧化法,向浸液1中加入Fe2(SO4)3,并调节pH,生成FeAsO4沉淀。欲使溶液中c(AsO42-)<10-9mol/L且不产生Fe(OH)3沉淀,应控制pH的范围为__________。
已知:1g2=0.3:;FeAsO4、Fe(OH)3的Ksp分别为5×10-23、4×10-38。
(6)“沉铋“时需控制溶液的pH=3.0,此时BiCl3发生反应的化学方程式为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列营养物质在人体内发生的变化及其对人的生命活动所起的作用叙述不正确的是( )
A.淀粉 ![]() 葡萄糖
葡萄糖 ![]() CO2和H2O(释放能量维持生命活动)
CO2和H2O(释放能量维持生命活动)
B.纤维素 ![]() 葡萄糖
葡萄糖 ![]() CO2和H2O(释放能量维持生命活动)
CO2和H2O(释放能量维持生命活动)
C.油脂 ![]() 甘油和高级脂肪酸
甘油和高级脂肪酸 ![]() CO2和H2O(释放能量维持生命活动)
CO2和H2O(释放能量维持生命活动)
D.蛋白质 ![]() 氨基酸
氨基酸 ![]() 人体所需的蛋白质(人体生长发育、新陈代谢)
人体所需的蛋白质(人体生长发育、新陈代谢)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】当前能源危机是一个全球性问题,开源节流是应对能源危机的重要举措。
(1)下列做法不利于能源“开源节流”的是________(填字母)。
A.开发太阳能、水能、风能等新能源,减少使用煤、石油等化石燃料
B.研究采煤、采油新技术,提高产量以满足工业生产的快速发展
C.大力发展农村沼气,将废弃的秸秆转化为清洁高效的能源
D.减少资源消耗、增加资源的重复使用和资源的循环再生

(2)金刚石和石墨均为碳的同素异形体,它们在氧气不足时燃烧生成一氧化碳,在氧气充足时充分燃烧生成二氧化碳,反应中放出的热量如图所示。则在通常状况下,金刚石和石墨相比较,_________(填 “金刚石”或“石墨”)更稳定,石墨的燃烧热ΔH=______________。
(3)N2、O2分子中化学键的键能分别是946 kJ/mol、497kJ/mol。已知:N2(g)+O2(g)=2NO(g) ΔH=+180.0 kJ/mol。NO分子中化学键的键能为_____。
(4)综合上述有关信息,请写出用CO除去NO生成无污染气体的热化学方程式:_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏伽德罗常数,下列说法正确的有( )
A.1molNa2O2晶体中共含有4NA个离子
B.0.1mol AlCl3完全水解转化为氢氧化铝胶体,生成0.1NA个胶粒
C.常温常压下16gO2和O3混合气体含有NA个氧原子
D.1mol/LNa2CO3溶液中含有NA个CO32﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
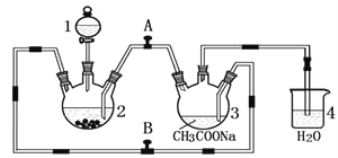
【题目】醋酸亚铬水合物 {[(CH3COO)2Cr]2·2H2O,相对分子质量为376}是一种深红色晶体,不溶于冷水,是常用的氧气吸收剂。实验室中以锌粒、三氯化铬溶液、醋酸钠溶液和盐酸为主要原料制备醋酸亚铬水合物,其装置如图所示,且仪器2中预先加入锌粒。已知二价铬不稳定,极易被氧气氧化,不与锌反应。制备过程中发生的相关反应如下:
Zn(s)+ 2HCl(aq)=ZnCl2(aq)+ H2(g);
2CrCl3(aq)+Zn(s)= 2CrCl2(aq)+ ZnCl2(aq)
2Cr2+(aq)+ 4CH3COO—(aq)+ 2H2O(l)=[(CH3COO)2Cr]2·2H2O(s)
请回答下列问题:
(1)仪器1的名称是______________________________________。
(2)往仪器2中加盐酸和三氯化铬溶液的顺序最好是____________(填序号);目的是_________________________。
A.盐酸和三氯化铬溶液同时加入
B.先加三氯化铬溶液,一段时间后再加盐酸
C.先加盐酸,一段时间后再加三氯化铬溶液
(3)为使生成的CrCl2溶液与醋酸钠溶液顺利混合,应关闭阀门_____(填“A”或“B",下同),打开阀门____。
(4)本实验中锌粒要过量,其原因除了让产生的H2将CrCl2溶液压入装置3与醋酸钠溶液反应外,另一个作用是_____________________________________________。
(5)已知其他反应物足量,实验时取用的CrCl3溶液中含溶质9.51g,取用的醋酸钠溶液为1.5L0.1mol/L;实验后得干燥纯净的[(CH3COO)2Cr]2·2H2O 9.4g,则该实验所得产品的产率为____________(不考虑溶解的醋酸亚铬水合物)。
(6)铬的离子会污染水,常温下要除去上述实验中多余的Cr2+,最好往废液中通入足量的_______,再加入碱液,调节pH至少为_______才能是铬的离子沉淀完全(铬的离子浓度应小于10-5mol/L)。【已知Cr(OH)3的溶度积为6.3×10-31,![]() ≈4,lg2≈0.3】
≈4,lg2≈0.3】
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com