
工业上制备氯化铜时,是将浓盐酸用蒸汽加热至80 ℃左右,慢慢加入粗制氧化铜粉末(含杂质氧化亚铁),充分搅拌,使之溶解,反应如下: CuO+2HCl=CuCl2+H2O;FeO+2HCl=FeCl2+H2O。已知: 当pH≥9.6时,Fe2+以Fe(OH)2形式完全沉淀; pH≥6.4时, Cu2+以Cu(OH)2形式完全沉淀;pH在3~4时, Fe3+以Fe(OH)3形式完全沉淀。除去溶液中的Fe2+可以采用的方法是
A.直接加碱,调整溶液pH≥9.6
B.加纯铜粉,将Fe2+还原出来
C.先将Fe2+氧化Fe3+成再调整pH至3~4
D.通入硫化氢,使Fe2+直接沉淀
科目:高中化学 来源:2016届黑龙江省高三上学期10月月考化学试卷(解析版) 题型:选择题
用惰性电极电解一定浓度的CuSO4溶液时,通电一段时间后,向所得的溶液中加入0.1 mol Cu2(OH)2CO3后恰好恢复到电解前的浓度和pH(不考虑二氧化碳的溶解)。则电解过程中转移电子的物质的量为
A.0.4 mol B.0.5 mol C.0.6 mol D.0.8 mol
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广东省高一上学期第一次月考化学试卷(解析版) 题型:选择题
某氯化镁溶液的密度为1.18 g·cm-3,其中镁离子的质量分数为5.1%, 300 mL该溶液中Cl-的物质的量约等于
A.0.37 mol B.0.63 mol C.0.74 mol D.1.5 mol
查看答案和解析>>
科目:高中化学 来源:2016届安徽省高三上学期第二次月考化学试卷(解析版) 题型:实验题
某小组同学为探究H2O2、H2SO3、Br2氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验)。
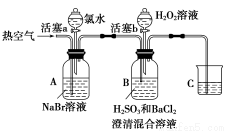
实验记录如下:
实验操作 | 实验现象 | |
Ⅰ | 打开活塞a,滴加氯水,关闭活塞a | A中溶液变为红棕色 |
Ⅱ | 吹入热空气 | A中红棕色明显变浅;B中有气泡,产生大量白色沉淀,混合液颜色无明显变化 |
Ⅲ | 停止吹入空气,打开活塞b,逐滴加入H2O2溶液 | 开始时颜色无明显变化;继续滴加H2O2溶液,一段时间后,混合液逐渐变成红棕色 |
请回答下列问题:
(1)A中反应的离子方程式是______________________________。
(2)实验操作Ⅱ吹入热空气的目的是________________________。
(3)装置C的作用是______________,C中盛放的药品是______________________。
(4)实验操作Ⅲ,混合液逐渐变成红棕色,其对应的离子方程式___________________。
(5)由上述实验得出的结论是______________________。
(6)实验反思:
①有同学认为实验操作Ⅱ吹入的热空气,会干扰(5)中结论的得出,你认为是否干扰,理由是__________________________。
②实验操作Ⅲ,开始时颜色无明显变化的原因是(写出一条即可):_____________________。
查看答案和解析>>
科目:高中化学 来源:2016届吉林省扶余市高三上学期第一次月考化学试卷(解析版) 题型:选择题
将NO3-+ Zn + OH- + H2O NH3+Zn(OH)42-配平后,H2O的计量数是
NH3+Zn(OH)42-配平后,H2O的计量数是
A.2 B.4 C.6 D.8
查看答案和解析>>
科目:高中化学 来源:2016届河北省邯郸市高三上学期10月月考化学试卷(解析版) 题型:实验题
工业上用菱锰矿(MnCO3)[含FeCO3、SiO2、Cu2(OH)2CO3等杂质]为原料制取二氧化锰,其流程示意图如下:
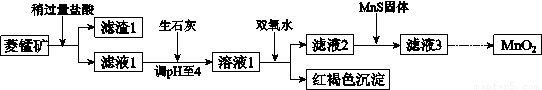
已知:生成氢氧化物沉淀的pH
Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
开始沉淀时 | 8.3 | 6.3 | 2.7 | 4.7 |
完全沉淀时 | 9.8 | 8.3 | 3.7 | 6.7 |
注:金属离子的起始浓度为0.1 mol/L
回答下列问题:
(1)含杂质的菱锰矿使用前需将其粉碎,主要目的是 。
盐酸溶解MnCO3的化学方程式是 。
(2)向溶液1中加入双氧水时,反应的离子方程式是 。
(3)将MnCl2转化为MnO2的一种方法是氧化法。其具体做法是用酸化的NaClO3溶液将MnCl2氧化,该反应的离子方程式为:□Mn2++□ClO3-+□H2O=□Cl2+□________+□________。
(4)将MnCl2转化为MnO2的另一种方法是电解法。
① 生成MnO2的电极反应式是 。
② 若直接电解MnCl2溶液,生成MnO2的同时会产生少量Cl2。检验Cl2的操作是 。
③ 若在上述MnCl2溶液中加入一定量的Mn(NO3)2粉末,则无Cl2产生。其原因是 。
查看答案和解析>>
科目:高中化学 来源:2016届山东省淄博市高三上学期10月月考化学试卷(解析版) 题型:选择题
向一定量的Fe、FeO和Fe2O3的混合物中加入120 mL 4 mol·L-1的稀硝酸,恰好使混合物完全溶解,放出1.344 L NO(标准状况),往所得溶液中加入KSCN溶液,无红色出现。若用足量的氢气在加热下还原相同质量的混合物,能得到铁的物质的量为
A.0.24 mol B.0.16 mol
C.0.21 mol D.0.14 mol
查看答案和解析>>
科目:高中化学 来源:2016届安徽省高三上学期开学联考化学试卷(解析版) 题型:选择题
某同学设计可如图所示的探究原电池的装置.下列有关说法正确的是
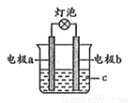
A.电极材料必须是金属材料
B.若a极为铜条、b极为锌片,c为蔗糖溶液时,灯泡会发亮
C.若a极为铝条、b极为铜片,c为浓硝酸溶液时,铜为负极
D.若a极为铝条、b极为镁片,c为稀硫酸溶液时,铝为负极
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山西省高二上期中考试化学试卷(解析版) 题型:选择题
根据如图所示的反应判断下列说法中错误的是
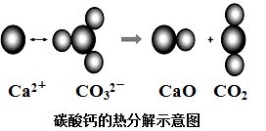
A.CO2(g)和CaO(s)的总能量大于CaCO3(s)的总能量
B.该反应的焓变大于零
C.该反应中有离子键断裂也有共价键断裂,化学键断裂吸收能量,化学键生成放出能量
D.由该反应可推出凡是需要加热才发生的反应均为吸热反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com