
| A.往新配制的可溶性淀粉溶液中滴加碘水,溶液显蓝色,用CCl4不能从中萃取出碘。 |
| B.硝酸钾饱和溶液冷却未出现结晶时,可以用玻棒充分磨擦器皿壁促使晶体析出。 |
| C.制备硫酸亚铁铵晶体时,最后在蒸发皿中蒸发浓缩溶液时,只需小火加热至溶液表面出现晶膜为止,不能将溶液全部蒸干。 |
| D.重结晶时,溶液冷却速度越慢得到的晶体颗粒越小。 |
 灵星计算小达人系列答案
灵星计算小达人系列答案科目:高中化学 来源:不详 题型:单选题
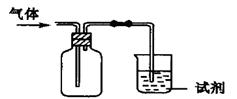
| 选项 | 气体 | 试剂 | 现象 | 结论 |
| A | Cl2 | 紫色石蕊试液 | 溶液先变红后褪色 | 氯水有酸性和漂白性 |
| B | NH3 | 水 | 无明显现象 | NH3能溶于水 |
| C | X | 澄清石灰水 | 溶液变浑浊 | 气体可能是CO2 |
| D | SO2 | 酸性KMnO4(aq) | 溶液褪色 | SO2有漂白性 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
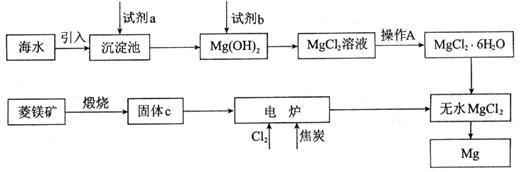
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
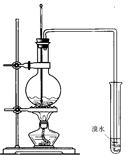
| A.废液直接倒入下水道 |
| B.废液倒入空废液缸中 |
| C.将水倒入烧瓶中 |
| D.废液倒入盛有水的塑料桶中,经处理后再倒入下水道 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
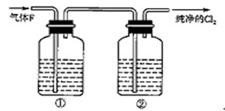
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 写出相关的化学方程式: 。
写出相关的化学方程式: 。查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
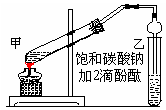
| A.中和乙酸和乙醇。 |
| B.中和乙酸并吸收部分乙醇。 |
| C.乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中更小,有利于分层析出。 |
| D.加速酯的生成,提高其产率。 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
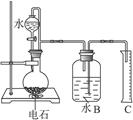
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com