
| A. | 升高温度 | B. | 增加压强 | C. | 增大反应物的量 | D. | 使用催化剂 |
 名校通行证有效作业系列答案
名校通行证有效作业系列答案科目:高中化学 来源: 题型:解答题
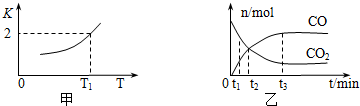
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| H2和Cl2的物质的量关系 | n(H2)=n(Cl2) | n(H2)>n(Cl2) | n(H2)<n(Cl2) |
| 生成NaCl的物质的量 | amol(或bmol) | bmol | amol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电池的电解质溶液为碱性溶液,阳离子向正极移动 | |
| B. | 电池放电时,负极反应为Fe+2OH--2e-=Fe(OH)2 | |
| C. | 电池充电过程中,阴极附近溶液的pH降低 | |
| D. | 电池充电时,阳极反应为2Ni(OH)2+2OH--2e-═Ni2O3+3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质所含元素化合价升高的反应是氧化反应 | |
| B. | 物质所含元素化合价降低的反应是还原反应 | |
| C. | 氧化剂本身被还原,具有氧化性;还原剂本身被氧化,具有还原性 | |
| D. | 氧化反应和还原反应不一定同时存在于一个反应中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
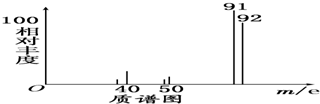
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在偏二甲肼与四氧化二氮的反应中,N2O4是氧化剂 | |
| B. | 两物质反应时,生成的无毒气体为CO2、N2、和H2O | |
| C. | 偏二甲肼中N元素的化合价均为-2价 | |
| D. | 偏二甲肼的同分异构体中,含碳碳单键的化合物只有2种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com