
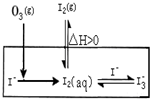
 大气中的部分碘源于O3对海水中I-的氧化.将O3持续通入NaI酸性溶液溶液中进行模拟研究.
大气中的部分碘源于O3对海水中I-的氧化.将O3持续通入NaI酸性溶液溶液中进行模拟研究.
c(
| ||
| c(I2)?c(I-) |
c(
| ||
| c(I2)?c(I-) |
| (0.2-0.09)mol/L |
| 0.2mol/L |
 故答案为:>;
故答案为:>; ;
;| 0.11 |
| t1 |
| 0.11 |
| 2t1 |
| 0.11 |
| 2t1 |


 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案科目:高中化学 来源: 题型:
| A、将SO2气体通入NaClO溶液中:SO2+2ClO-+H2O=SO32-+2HClO |
| B、Na2S水解:S2-+2H2O?H2S+2OH- |
| C、向硫酸氢钾溶液中加入Ba(OH)2溶液至中性:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O |
| D、NH4HCO3溶液与过量NaOH溶液反应:NH4++OH-=NH3↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、BaSO4可做钡餐而BaCO3不能是因为Ksp(BaSO4)<Ksp(BaCO3) |
| B、在制腈纶纤维的1 L溶液中含SO42-为1.0×10-3 mol,则加入0.01 mol BaCl2不能使SO42-完全沉淀 |
| C、在清理有关仪器的BaSO4沉淀时,常加入饱和Na2CO3溶液,使BaSO4转化为BaCO3再用酸处理 |
| D、用稀H2SO4洗涤BaSO4效果比用水好,BaCO3也能用此法处理 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、由溶解性CaCO3<Ca(HCO3)2,则溶解性Na2CO3<NaHCO3 |
| B、向Ca(ClO)2溶液中通入少量CO2可得到CaCO3,则向Ca(ClO)2溶液中通入少量SO2可得到CaSO3 |
| C、由O2与Li加热生成Li2O,则O2与Na加热生成Na2O |
| D、有Fe与S加热生成FeS,则Cu与S加热生成Cu2S |
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
A、2H2SO4(浓)+Cu
| ||||
B、2H2SO4 (浓)+C
| ||||
C、H2SO4 (浓)+NaCl
| ||||
| D、H2SO4+Na2SO3═Na2SO4+H2O+SO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
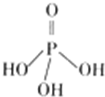 磷单质及其化合物在工业有广泛应用.
磷单质及其化合物在工业有广泛应用.查看答案和解析>>
科目:高中化学 来源: 题型:
 利用下列各组物质制备和收集少量相应气体,能采用如图实验装置的是( )
利用下列各组物质制备和收集少量相应气体,能采用如图实验装置的是( )| A、①②⑥ | B、②④ |
| C、①②③⑥ | D、全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:
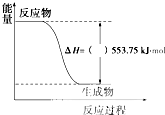 (1)许多运动会使用的火炬内熊熊大火来源于丙烷的燃烧,丙烷是一种优良的燃料.试回答下列问题:
(1)许多运动会使用的火炬内熊熊大火来源于丙烷的燃烧,丙烷是一种优良的燃料.试回答下列问题:| 1 |
| 2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com