
【题目】已知X、Y和Z三种元素的原子序数之和等于42。X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子。X与Y可形成化合物![]() ,2元素可形成负一价离子。下列说法正确的是( )
,2元素可形成负一价离子。下列说法正确的是( )
A.X元素基态原子的电子排布式为![]()
B.X元素是第4周期第VA族元素
C.Y元素原子的轨道表示式为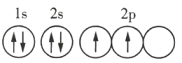
D.Z元素的单质Z2在氧气中不能燃烧
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】某化学研究性学习小组为了制取焦亚硫酸钠(![]() ),并对其性质进行研究。特进行如下实验:
),并对其性质进行研究。特进行如下实验:
实验一 制取焦亚硫酸钠。
研究小组采用下图装置(实验前已除尽装置内的空气)制取![]() 。装置Ⅱ中有
。装置Ⅱ中有![]() 晶体析出,发生的反应为:
晶体析出,发生的反应为:![]() 。
。
(1)装置Ⅰ中通常采用70%~80%的浓硫酸与亚硫酸钠固体反应制取![]() ,而不用98%的浓硫酸或极稀的稀硫酸,原因是________________________。
,而不用98%的浓硫酸或极稀的稀硫酸,原因是________________________。
(2)若要从装置Ⅱ中获得已析出的晶体,所采取的分离方法需用到的玻璃仪器有________。
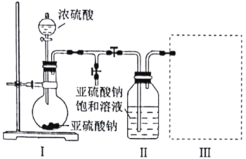
(3)装置Ⅲ用于处理尾气,请画出用来处理尾气并防止发生倒吸的实验装置,注明相应的试剂。
____________________________________________________________
(4)已知![]() 溶于水后,立即生成
溶于水后,立即生成![]() ,该反应的离子方程式为________________________。
,该反应的离子方程式为________________________。
(5)用![]() 试纸测得
试纸测得![]() 溶液呈酸性,其溶液呈酸性的原因是________________________。
溶液呈酸性,其溶液呈酸性的原因是________________________。
(6)取少量焦亚硫酸钠晶体于试管中,其中滴加酸性![]() 溶液,剧烈反应,溶液紫红色很快褪去,经测定溶液中产生
溶液,剧烈反应,溶液紫红色很快褪去,经测定溶液中产生![]() ,该反应的离子方程式是________________________。
,该反应的离子方程式是________________________。
实验三 焦亚硫酸钠的含量测定。
测定产品中焦亚硫酸钠的质量分数常用剩余碘量法。
已知:![]() ;
;![]() 。
。
①精确称取干燥的产品![]() 放入碘量瓶(带磨口塞的锥形瓶)中。
放入碘量瓶(带磨口塞的锥形瓶)中。
②向碘量瓶中准确移取![]() ,
,![]() 的标准碘溶液(过量),振荡,使其与产品中的焦亚硫酸钠充分反应。
的标准碘溶液(过量),振荡,使其与产品中的焦亚硫酸钠充分反应。
③加入![]() 淀粉溶液,用标准
淀粉溶液,用标准![]() 溶液滴定至接近终点,重复操作3次,经计算得消耗标准液平均体积为
溶液滴定至接近终点,重复操作3次,经计算得消耗标准液平均体积为![]() 。
。
(7)上述实验操作滴定终点的现象为________________________;根据上述实验,计算产品中焦亚硫酸钠的质量分数为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下可实现下图所示物质之间的变化:
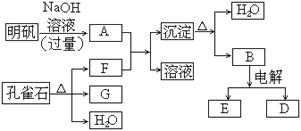
请填写以下空白:
(1)孔雀石的主要成分是CuCO3·Cu(OH)2(碱式碳酸铜),受热易分解。下图中的F是_____。
(2)写出明矾溶液与过量NaOH溶液反应的离子方程式:________。
(3)图中所得G和D都为固体,混和后在高温下可发生反应,写出该反应的化学方程式:____________。
(4)每生成1摩D,同时生成______摩E。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用![]() 表示原子:
表示原子:
(1)中性原子的中子数:N=________。
(2)阳离子的中子数:![]() 共有x个电子,则N=________。
共有x个电子,则N=________。
(3)阴离子的中子数:![]() 共有x个电子,则N=________。
共有x个电子,则N=________。
(4)中性分子或原子团的中子数:![]() 分子中,N=________。
分子中,N=________。
(5)A2-原子核内有x个中子,其质量数为m,则ng A2-所含电子的物质的量为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】方铅矿(PbS)与黄铁矿(FeS2)两矿法酸溶铅的示意图如下,下列说法错误的是( )
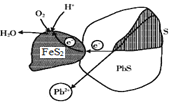
A.PbS上的电势比FeS2上的低
B.浸取液的pH随反应的进行逐渐增大
C.PbS表面发生的反应为PbS-2e-=Pb2++ S
D.FeS2表面发生的反应为FeS2+2e-=Fe2++ 2S2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中不正确的是![]()
![]()
①质子数相同的微粒一定属于同一种元素![]()
②同位素的性质相同![]()
③质子数相同、电子数也相同的微粒,不可能是一种分子和一种离子![]()
④电子数相同的微粒不一定是同一种元素![]()
⑤一种元素只能有一种质量数![]()
⑥某种元素的相对原子质量取整数,就是其质量数![]()
⑦![]() 中
中![]() 与
与![]() 的原子个数之比与NaCl中的
的原子个数之比与NaCl中的![]() 与
与![]() 的原子个数之比相等
的原子个数之比相等
A.②③⑤⑥⑦B.①②④⑤C.①②⑤⑥D.③④⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中不正确的是
①质子数相同的微粒一定属于同一种元素
②同位素的性质几乎相同
③质子数相同,电子数也相同的两种微粒,不可能是一种分子和一种离子
④某种元素的相对原子质量取整数,就是其质量数
⑤一种元素只能有一种质量数
⑥电子数相同的微粒不一定是同一种元素。
A.②③⑤⑥B.①②④⑤C.①②⑤⑥D.③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一无色透明溶液,取出少量滴入BaCl2溶液,只有白色沉淀生成;另取一定体积的无色溶液加入过量Na2O,有白色沉淀生成,其沉淀量与加入Na2O的量的关系如图所示。原无色透明溶液中一定存在的离子是
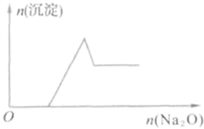
①H+ ②NH4+ ③Al3+ ④Mg2+ ⑤Fe2+ ⑥NO3- ⑦SO42-
A.③④B.③④⑦C.①③④⑦D.②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰氯(ClNO)常用作催化剂和合成洗涤剂,某学习小组在实验室中用下图所示装置制备ClNO。查阅资料:亚硝酰氯(ClNO)的熔点为-64.5℃、沸点为-5.5℃,气态呈黄色,液态时呈红褐色,遇水易反应生成一种氢化物和两种氮的常见氧化物,其中一种呈红棕色。
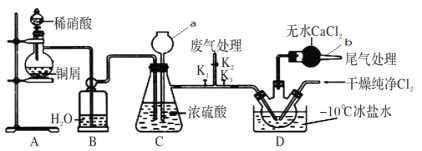
回答下列问题:
(1)仪器a的名称为________,b的作用是________。
(2)ClNO分子中各原子均满足8电子稳定结构,则ClNO的电子式为__________;ClNO与水反应的化学方程式为__________。
(3)实验开始时,先打开K1、K2,关闭K3,再打开分液漏斗活塞滴入适量稀硝酸,当观察到C中_________________时关闭K1、K2;向装置D三颈瓶中通入干燥纯净Cl2,当瓶中充满黄绿色气体时,再打开K1、K3,制备ClNO,D中发生的反应方程式为________。
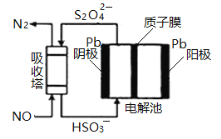
(4)NO可用间接电化学法除去,其原理如下图所示。电解池阴极的电极反应式为________;吸收塔内发生的离子方程式为_______。
(5)亚硝酰氯(ClNO)纯度的测定:将所得亚硝酰氯(ClNO)产品13.10g溶于水,配制成250mL溶液;取出25.00mL,以K2CrO4溶液为指示剂,用0.87mol·L-1AgNO3标准溶液滴定至终点,消耗标准溶液的体积为 20.00mL。(已知:Ag2CrO4为砖红色固体),则亚硝酰氯(ClNO)的质量分数为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com