
| A. | 在任何温度下都能自发进行 | B. | 在任何温度下都不能自发进行 | ||
| C. | 仅在高温下自发进行 | D. | 仅在低温下自发进行 |
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100 mL 0.1 mol/L的Na2CO3溶液中加入0.01 molCH3COOH:CO32-+CH3COOH═HCO3-+CH3COO- | |
| B. | 4 mol/L的NaAlO2溶液和7 mol/L的盐酸等体积均匀混合:4AlO2-+7H++H2O═3Al(OH)3↓+Al3+ | |
| C. | 向HCOOK和KOH的混合溶液中加入KMnO42KMnO4+HCOOK+KOH═2K2MnO4+CO2↑+H2O | |
| D. | 在含有Mn2+的溶液中加入HNO3再加入PbO2,则反应体系显紫红色:5PbO2+2Mn2++4H+═5Pb2++2MnO4-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 该溶液由pH=3的CH3COOH与pH=11的NaOH溶液等体积混合而成 | |
| B. | 该溶液由等物质的量浓度、等体积的NaOH溶液和CH3COOH溶液混合而成 | |
| C. | 加入适量的NaOH,溶液中离子浓度为c(CH3COO-)>c(Na+)>c(OH-)>c(H+) | |
| D. | 加入适量氨水后,c(CH3COO-)会大于c(Na+)、c(NH4+)之和 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=2的醋酸溶液与pH=12的NaOH溶液等体积混合:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) | |
| B. | 向NH4HSO4溶液中滴加等物质的量的NaOH形成的溶液中:c(Na+)=c(SO42-)>c(NH4+)>c(H+)>c(OH-) | |
| C. | NaHCO3溶液中:c(OH-)-c(H+)=c(H2CO3)-c(CO32-) | |
| D. | 在浓度均为0.1 mol•L-1Na2CO3、NaHCO3、NH4Cl溶液中c(H+)分别为c1、c2、c3,则c3>c2>c1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④ | B. | ①③ | C. | ②③ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 、
、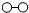 、
、 分别表示N2、H2、NH3,下列说法正确的是( )
分别表示N2、H2、NH3,下列说法正确的是( )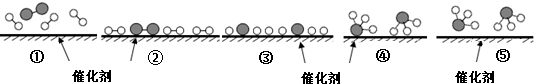
| A. | 使用催化剂,合成氨反应放出的热量减少 | |
| B. | 在该过程中,N2、H2断键形成N原子和H原子 | |
| C. | 在该过程中,N原子和H原子形成了含有非极性键的NH3 | |
| D. | 合成氨反应中,反应物断键吸收能量大于生成物形成新键释放的能量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com